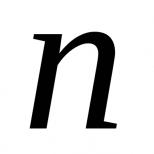Волновая функция. Волновая функция и ее физический смысл. Зависимое от времени уравнение
Экспериментальное подтверждение идеи Луи де Бройля об универсальности корпускулярно-волнового дуализма, ограниченность применения классической механики к микрообъектам, диктуемая соотношением неопределенностей, а также противоречия ряда экспериментов с применяемыми в начале XX века теориями привели к новому этапу развития квантовой физики – созданию квантовой механики, описывающей законы движения и взаимодействия микрочастиц с учетом их волновых свойств. Ее создание и развитие охватывает период с 1900 г. (формулировка Планком квантовой гипотезы) до 20-х годов XX века и связано, прежде всего, с работами австрийского физика Э. Шредингера, немецкого физика В. Гейзенберга и английского физика П. Дирака.
Необходимость вероятностного подхода к описанию микрочастиц является важнейшей отличительной особенностью квантовой теории. Можно ли волны де Бройля истолковывать как волны вероятности, т.е. считать, что вероятность обнаружить микрочастицу в различных точках пространства меняется по волновому закону? Такое толкование волн де Бройля уже неверно, хотя бы потому, что тогда вероятность обнаружить частицу в некоторых точках пространства может быть отрицательна, что не имеет смысла.
Чтобы устранить эти трудности, немецкий физик М. Борн в 1926 г. предположил, что по волновому закону меняется не сама вероятность , а величина , названная амплитудой вероятности и обозначаемая . Эту величину называют также волновой функцией (или -функцией). Амплитуда вероятности может быть комплексной, и вероятность W пропорциональна квадрату ее модуля:
|
|
(4.3.1) |
где , где – функция комплексно-сопряженная с Ψ.
Таким образом, описание состояния микрообъекта с помощью волновой функции имеет статистический , вероятностный характер: квадрат модуля волновой функции (квадрат модуля амплитуды волны де Бройля) определяет вероятность нахождения частицы в момент времени в области с координатами x и dx , y и dy , z и dz .
Итак, в квантовой механике состояние частицы описывается принципиально по-новому – с помощью волновой функции, которая является основным носителем информации об их корпускулярных и волновых
| . | (4.3.2) |
Величина ![]() (квадрат модуля Ψ-функции) имеет смысл плотности вероятности
, т.е. определяет вероятность нахождения частицы в единице объема в окрестности точки
, имеющей
координаты
x
, y
, z
. Таким образом, физический смысл имеет не сама Ψ-функция, а квадрат ее модуля , которым определяется интенсивность волн де Бройля
.
(квадрат модуля Ψ-функции) имеет смысл плотности вероятности
, т.е. определяет вероятность нахождения частицы в единице объема в окрестности точки
, имеющей
координаты
x
, y
, z
. Таким образом, физический смысл имеет не сама Ψ-функция, а квадрат ее модуля , которым определяется интенсивность волн де Бройля
.
Вероятность найти частицу в момент времени t в конечном объеме V , согласно теореме о сложении вероятностей, равна:
![]() .
.
Т.к. определяется как вероятность, то необходимо волновую функцию Ψ представить так, чтобы вероятность достоверного события обращалась в единицу, если за объем V принять бесконечный объем всего пространства. Это означает, что при данном условии частица должна находиться где-то в пространстве. Следовательно, условие нормировки вероятностей:
| (4.3.3) |
где данный интеграл вычисляется по всему бесконечному пространству, т.е. по координатам x , y , z от до . Таким образом, условие нормировки говорит об объективном существовании частицы во времени и пространстве.
Чтобы волновая функция являлась объективной характеристикой состояния микрочастицы, она должна удовлетворять ряду ограничительных условий. Функция Ψ, характеризующая вероятность обнаружения микрочастицы в элементе объема, должна быть:
· конечной (вероятность не может быть больше единицы);
· однозначной (вероятность не может быть неоднозначной величиной);
· непрерывной (вероятность не может меняться скачком).
Волновая функция удовлетворяет принципу суперпозиции: если система может находиться в различных состояниях, описываемых волновыми функциями , , … , то она может находиться в состоянии, описываемом линейной комбинацией этих функций:
где (n = 1, 2, 3…) – произвольные, вообще говоря, комплексные числа.
Сложение волновых функций (амплитуд вероятностей, определяемых квадратами модулей волновых функций) принципиально отличает квантовую теорию от классической статистической теории , в которой для независимых событий справедлива теорема сложения вероятностей.
Волновая функция Ψ является основной характеристикой состояния микрообъектов . Например, среднее расстояние электрона от ядра вычисляется по формуле
![]() ,
,
Волнова́я фу́нкция , или пси-фу́нкция ψ {\displaystyle \psi } - комплекснозначная функция , используемая в квантовой механике для описания чистого состояния системы . Является коэффициентом разложения вектора состояния по базису (обычно координатному):
| ψ (t) ⟩ = ∫ Ψ (x , t) | x ⟩ d x {\displaystyle \left|\psi (t)\right\rangle =\int \Psi (x,t)\left|x\right\rangle dx}
где | x ⟩ = | x 1 , x 2 , … , x n ⟩ {\displaystyle \left|x\right\rangle =\left|x_{1},x_{2},\ldots ,x_{n}\right\rangle } - координатный базисный вектор, а Ψ (x , t) = ⟨ x | ψ (t) ⟩ {\displaystyle \Psi (x,t)=\langle x\left|\psi (t)\right\rangle } - волновая функция в координатном представлении.
Нормированность волновой функции
Волновая функция Ψ {\displaystyle \Psi } по своему смыслу должна удовлетворять так называемому условию нормировки, например, в координатном представлении имеющему вид:
∫ V Ψ ∗ Ψ d V = 1 {\displaystyle {\int \limits _{V}{\Psi ^{\ast }\Psi }dV}=1}Это условие выражает тот факт, что вероятность обнаружить частицу с данной волновой функцией где-либо в пространстве равна единице. В общем случае интегрирование должно производиться по всем переменным, от которых зависит волновая функция в данном представлении.
Принцип суперпозиции квантовых состояний
Для волновых функций справедлив принцип суперпозиции , заключающийся в том, что если система может пребывать в состояниях, описываемых волновыми функциями Ψ 1 {\displaystyle \Psi _{1}} и Ψ 2 {\displaystyle \Psi _{2}} , то она может пребывать и в состоянии, описываемом волновой функцией
Ψ Σ = c 1 Ψ 1 + c 2 Ψ 2 {\displaystyle \Psi _{\Sigma }=c_{1}\Psi _{1}+c_{2}\Psi _{2}} при любых комплексных c 1 {\displaystyle c_{1}} и c 2 {\displaystyle c_{2}} .
Очевидно, что можно говорить и о суперпозиции (сложении) любого числа квантовых состояний, то есть о существовании квантового состояния системы, которое описывается волновой функцией Ψ Σ = c 1 Ψ 1 + c 2 Ψ 2 + … + c N Ψ N = ∑ n = 1 N c n Ψ n {\displaystyle \Psi _{\Sigma }=c_{1}\Psi _{1}+c_{2}\Psi _{2}+\ldots +{c}_{N}{\Psi }_{N}=\sum _{n=1}^{N}{c}_{n}{\Psi }_{n}} .
В таком состоянии квадрат модуля коэффициента c n {\displaystyle {c}_{n}} определяет вероятность того, что при измерении система будет обнаружена в состоянии, описываемом волновой функцией Ψ n {\displaystyle {\Psi }_{n}} .
Поэтому для нормированных волновых функций ∑ n = 1 N | c n | 2 = 1 {\displaystyle \sum _{n=1}^{N}\left|c_{n}\right|^{2}=1} .
Условия регулярности волновой функции
Вероятностный смысл волновой функции накладывает определенные ограничения, или условия, на волновые функции в задачах квантовой механики. Эти стандартные условия часто называют условиями регулярности волновой функции.
Волновая функция в различных представлениях используется состояния в различных представлениях - будет соответствовать выражению одного и того же вектора в разных системах координат. Остальные операции с волновыми функциями так же будут иметь аналоги на языке векторов. В волновой механике используется представление, где аргументами пси-функции является полная система непрерывных коммутирующих наблюдаемых, а в матричной используется представление, где аргументами пси-функции является полная система дискретных коммутирующих наблюдаемых. Поэтому функциональная (волновая) и матричная формулировки очевидно математически эквивалентны.
Для описания корпускулярно-волновых свойств электрона в квантовой механике используют волновую функцию, которая обозначается греческой буквой пси (Т). Главные свойства волновой функции таковы:
- в любой точке пространства с координатами х, у, z она имеет определенные знак и амплитуду: ЧДд:, у , г);
- квадрат модуля волновой функции | ЧДх, y,z) | 2 равен вероятности нахождения частицы в единице объема, т.е. плотности вероятности.
Плотность вероятности обнаружения электрона на различных расстояниях от ядра атома изображают несколькими способами. Часто ее характеризуют числом точек в единице объема (рис. 9.1, а). Точечное изображение плотности вероятности напоминает облако. Говоря об электронном облаке, следует иметь в виду, что электрон - это частица, проявляющая одновременно и корпускулярные, и волновые
Рис. 9.1.
свойства. Область вероятности обнаружения электрона не имеет четких границ. Однако можно выделить пространство, где вероятность его обнаружения велика или даже максимальна.
На рис. 9.1, а штриховой линией обозначена сферическая поверхность, внутри которой вероятность обнаружения электрона составляет 90%. На рис. 9.1, б приведено контурное изображение электронной плотности в атоме водорода. Ближайший к ядру контур охватывает область пространства, в которой вероятность обнаружения электрона 10%, вероятность же обнаружения электрона внутри второго от ядра контура составляет 20%, внутри третьего - 30% и т.д. На рис. 9.1, в электронное облако изображено в виде сферической поверхности, внутри которой вероятность обнаружения электрона составляет 90%.
Наконец, на рис. 9.1, г и б двумя способами показана вероятность обнаружения электрона Is на разных расстояниях г от ядра: вверху показан «разрез» этой вероятности, проходящий через ядро, а внизу - сама функция 4лг 2 |У| 2 .
Уравнение Шрёдингсра. Это фундаментальное уравнение квантовой механики было сформулировано австрийским физиком Э. Шрёдингером в 1926 г. Оно связывает полную энергию частицы Е, равную сумме потенциальной и кинетической энергий, потенциальную энергию?„, массу частицы т и волновую функцию 4*. Для одной частицы, например электрона массой т е, оно имеет следующий вид :
С математической точки зрения это уравнение с тремя неизвестными: У, Е и?„. Решить его, т.е. найти эти неизвестные, можно, если решать его совместно с двумя другими уравнениями (для нахождения трех неизвестных требуется три уравнения). В качестве таких уравнений используют уравнения для потенциальной энергии и граничных условий.
Уравнение потенциальной энергии не содержит волно- вую функцию У. Оно описывает взаимодействие заряженных частиц по закону Кулона. При взаимодействии одного электрона с ядром, имеющим заряд +z, потенциальная энергия равна
где г = У* 2 + у 2 + z 2 .
Это случай так называемого одноэлектронного атома. В более сложных системах, когда заряженных частиц много, уравнение потенциальной энергии состоит из суммы таких же кулоновских членов.
Уравнением граничных условий является выражение
Оно означает, что волновая функция электрона стремится к нулю на больших расстояниях от ядра атома.
Решение уравнения Шрёдингера позволяет найти волновую функцию электрона? = (х, у , z) как функцию координат. Это распределение называется орбиталью.
Орбиталь - это заданная в пространстве волновая функция.
Система уравнений, включающая уравнения Шрёдингера, потенциальной энергии и граничных условий, имеет не одно, а много решений. Каждое из решений одновременно включает 4 х = (х, у , г) и Е , т.е. описывает электронное облако и соответствующую ему полную энергию. Каждое из решений определяется квантовыми числами.
Физический смысл квантовых чисел можно понять, рассмотрев колебания струны, в результате которых образуется стоячая волна (рис. 9.2).
Длина стоячей волны X и длина струны b связаны уравнением
Длина стоячей волны может иметь лишь строго определенные значения, отвечающие числу п, которое принимает только целочисленные неотрицательные значения 1,2,3 и т.д. Как очевидно из рис. 9.2, число максимумов амплитуды колебаний, т.е. форма стоячей волны, однозначно определяется значением п.
Поскольку электронная волна в атоме представляет собой более сложный процесс, чем стоячая волна струны, значения волновой функции электрона определяются не одним, а че-

Рис. 9.2.
тырьмя числами, которые называются квантовыми числами и обозначаются буквами п, /, т и s. Данному набору квантовых чисел п, /, т одновременно отвечают определенная волновая функция Ч"лДл, и полная энергия E„j. Квантовое число т при Е не указывают, так как в отсутствие внешнего поля энергия электрона от т не зависит. Квантовое число s не влияет ни на 4* п хт, ни на E n j.
- , ~ elxv dlxv 62*p
- Символы --, --- означают вторые частные производные от fir1 дуг 8z2 Ч"-функции. Это производные от первых производных. Смысл первой производной совпадает с тангенсом угла наклона функции Ч" от аргумента х, уили z на графиках? = j(x), Т =/2(у), Ч" =/:!(z).
ВОЛНОВАЯ ФУНКЦИЯ, в КВАНТОВОЙ МЕХАНИКЕ функция, позволяющая найти вероятность того, что квантовая система находится в некотором состоянии s в момент времени t. Обычно пишется: (s) или (s, t). Волновая функция используется в уравнении ШРЕДИНГЕРА … Научно-технический энциклопедический словарь
ВОЛНОВАЯ ФУНКЦИЯ Современная энциклопедия
Волновая функция - ВОЛНОВАЯ ФУНКЦИЯ, в квантовой механике основная величина (в общем случае комплексная), описывающая состояние системы и позволяющая находить вероятности и средние значения характеризующих эту систему физических величин. Квадрат модуля волновой… … Иллюстрированный энциклопедический словарь
ВОЛНОВАЯ ФУНКЦИЯ - (вектор состояния) в квантовой механике основная величина, описывающая состояние системы и позволяющая находить вероятности и средние значения характеризующих ее физических величин. Квадрат модуля волновой функции равен вероятности данного… … Большой Энциклопедический словарь
ВОЛНОВАЯ ФУНКЦИЯ - в квантовой механике (амплитуда вероятности, вектор состояния), величина, полностью описывающая состояние микрообъекта (эл на, протона, атома, молекулы) и вообще любой квант. системы. Описание состояния микрообъекта с помощью В. ф. имеет… … Физическая энциклопедия
волновая функция - — [Л.Г.Суменко. Англо русский словарь по информационным технологиям. М.: ГП ЦНИИС, 2003.] Тематики информационные технологии в целом EN wave function … Справочник технического переводчика
волновая функция - (амплитуда вероятности, вектор состояния), в квантовой механике основная величина, описывающая состояние системы и позволяющая находить вероятности и средние значения характеризующих её физических величин. Квадрат модуля волновой функции равен… … Энциклопедический словарь
волновая функция - banginė funkcija statusas T sritis fizika atitikmenys: angl. wave function vok. Wellenfunktion, f rus. волновая функция, f; волнообразная функция, f pranc. fonction d’onde, f … Fizikos terminų žodynas
волновая функция - banginė funkcija statusas T sritis chemija apibrėžtis Dydis, apibūdinantis mikrodalelių ar jų sistemų fizikinę būseną. atitikmenys: angl. wave function rus. волновая функция … Chemijos terminų aiškinamasis žodynas
ВОЛНОВАЯ ФУНКЦИЯ - комплексная функция, описывающая состояние квантовомех. системы и позволяющая находить вероятности и ср. значения характеризуемых ею физ. величин. Квадрат модуля В. ф. равен вероятности данного состояния, поэтому В.ф. наз. также амплитудой… … Естествознание. Энциклопедический словарь
Книги
- , Б. К. Новосадов. Монография посвящена последовательному изложению квантовой теории молекулярных систем, а также решению волновых уравнений в нерелятивистской и релятивистской квантовой механике молекул.… Купить за 882 грн (только Украина)
- Методы математической физики молекулярных систем , Новосадов Б.К.. Монография посвящена последовательному изложению квантовой теории молекулярных систем, а также решению волновых уравнений в нерелятивистской и релятивистской квантовой механике молекул.…
Постулаты Бора
Планетарная модель атома позволила объяснить результаты опытов по рассеянию альфа-частиц вещества, однако возникли принципиальные трудности при обосновании устойчивости атомов.
Первая попытка построить качественно новую – квантовую – теорию атома была предпринята в 1913 г. Нильсом Бором. Он поставил цель связать в единое целое эмпирические закономерности линейчатых спектров, ядерную модель атома Резерфорда и квантовый характер излучения и поглощения света. В основу своей теории Бор положил ядерную модель Резерфорда. Он предположил, что электроны движутся вокруг ядра по круговым орбитам. Движение по окружности даже с постоянной скоростью обладает ускорением. Такое ускоренное движение заряда эквивалентно переменному току, который создает в пространстве переменное электромагнитное поле. На создание этого поля расходуется энергия. Энергия поля может создаваться за счет энергии кулоновского взаимодействия электрона с ядром. В результате электрон должен двигаться по спирали и упасть на ядро. Однако опыт показывает, что атомы – очень устойчивые образования. Отсюда следует вывод, что результаты классической электродинамики, основанной на уравнениях Максвелла, неприменимы к внутриатомным процессам. Необходимо найти новые закономерности. В основу своей теории атома Бор положил следующие постулаты.
Первый постулат Бора
(постулат стационарных состояний): в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн.
Этот постулат находится в противоречии с классической теорией. В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные квантовые значения момента импульса.
Второй постулат Бора
(правило частот): при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией
равной разности энергий соответствующих стационарных состояний (Еn и Еm – соответственно энергии стационарных состояний атома до и после излучения/поглощения).
Переходу электрона со стационарной орбиты под номером m на стационарную орбиту под номером n
соответствует переход атома из состояния с энергией Еm
в состояние с энергией Еn (рис. 4.1).
Рис. 4.1. К пояснению постулатов Бора
При Еn > Еm происходит излучение фотона (переход атома из состояния с большей энергией в состояние с меньшей энергией, т. е. переход электрона с более удаленной от ядра орбиты на более близлежащую), при Еn < Еm – его поглощение (переход атома в состояние с большей энергией, т. е, переход электрона на более удаленную от ядра орбиту). Набор возможных дискретных частот![]()
квантовых переходов и определяет линейчатый спектр атома.
Теория Бора блестяще объяснила экспериментально наблюдаемый линейчатый спектр водорода.
Успехи теории атома водорода были получены ценой отказа от фундаментальных положений классической механики, которая на протяжении более 200 лет остается безусловно справедливой. Поэтому большое значение имело прямое экспериментальное доказательство справедливости постулатов Бора, особенно первого – о существовании стационарных состояний. Второй постулат можно рассматривать как следствие закона сохранения энергии и гипотезы о существовании фотонов.
Немецкие физики Д. Франк и Г. Герц, изучая методом задерживающего потенциала столкновение электронов с атомами газов (1913г.), экспериментально подтвердили существование стационарных состояний и дискретность значений энергии атомов.
Несмотря на несомненный успех концепции Бора применительно к атому водорода, для которого оказалось возможным построить количественную теорию спектра, создать подобную теорию для следующего за водородом атома гелия на основе представлений Бора не удалось. Относительно атома гелия и более сложных атомов теория Бора позволила делать лишь качественные (хотя и очень важные) заключения. Представление об определенных орбитах, по которым движется электрон в атоме Бора, оказалось весьма условным. На самом деле движение электронов в атоме имеет мало общего с движением планет по орбитам.
В настоящее время с помощью квантовой механики можно ответить на многие вопросы, касающиеся строения и свойств атомов любых элементов.
5. основные положения квантовой механики:
Волновая функция и ее физический смысл.
Из содержания предыдущих двух параграфов следует, что с микрочастицей сопоставляют волновой процесс, который соответствует ее движению, поэтому состояние частицы в квантовой механике описывают волновой функцией , которая зависит от координат и времени y(x,y,z,t). Конкретный вид y -функции определяется состоянием частицы, характером действующих на нее сил. Если силовое поле, действующее на частицу, является стационарным, т.е. не зависящим от времени, то y -функцию можно представить в виде произведения двух сомножителей, один из которых зависит от времени, а другой – от координат:
В дальнейшем будем рассматривать только стационарные состояния. y-функция является вероятностной характеристикой состояния частицы. Чтобы пояснить это, мысленно выделим достаточно малый объем , в пределах которого значения y-функции будем считать одинаковыми. Тогда вероятность нахождения dW частицы в данном объеме пропорциональна ему и зависит от квадрата модуля y-функции (квадрата модуля амплитуды волн де Бройля):
Отсюда следует физический смысл волновой функции:
Квадрат модуля волновой функции имеет смысл плотности вероятности, т.е. определяет вероятность нахождения частицы в единичном объеме в окрестности точки с координатами х, у, z.
Интегрируя выражение (3.2) по объему, определяем вероятность нахождения частицы в этом объеме в условиях стационарного поля:
Если известно, что частица находится в пределах объема V, то интеграл выражения (3.4), взятый по объему V, должен быть равен единице:
– условие нормировки y-функции.
Чтобы волновая функция являлась объективной характеристикой состояния микрочастиц, она должна быть конечной, однозначной, непрерывной , так как вероятность не может быть больше единицы, не может быть неоднозначной величиной и не может изменяться скачками. Таким образом, состояние микрочастицы полностью определяется волновой функцией. Частица может быть обнаружена в любой точке пространства, в которой волновая функция отлична от нуля.