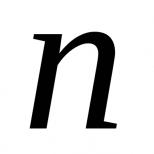Характеристика химических элементов 3 группы главной подгруппы. Общая характеристика. Свойства. Взаимодействие со сложными веществами
К р-элементам III группы периодической системы Д. И. Менделеева относятся: бор В, алюминий галлий индий и таллий Электронная конфигурация атомов
Ниже сопоставлены некоторые константы, характеризующие свойства атомов р-элементов рассматриваемой группы и соответствующих металлических веществ:

На свойствах -элементов III группы сказывается d-сжатие располагается в периодической системе в малом III периоде, в больших периодах непосредственно после d-элементов). Так, от атомный радиус несколько уменьшается, а первый ионизационный потенциал возрастает. На свойствах атомов таллия, кроме того, сказывается и -сжатие. Именно поэтому радиус атома близок радиусу атома а энергия ионизации несколько выше.
Бор. В соответствии с электронной структурой атома бор может быть одновалентным (один неспаренный электрон на энергетическом -подуровне). Однако для бора наиболее характерны соединения, в которых он трехвалентен (при возбуждении. атома три неспаренных электрона в энергетических и -подуровнях).
Свободная -орбиталь в возбужденном атоме бора обусловливает акцепторные свойства многих его соединений, в которых три ковалентные связи образованы по обменному ковалентному механизму (например, Эти соединения склонны к присоединению частиц с электронно-донорными свойствами, т. е. к образованию еще одной ковалентной связи по донорно-акцепторному механизму. Например:
Известны два изотопа бора: Ядра атомов изотопа легко поглощают нейтроны:
![]()
Способность бора поглощать нейтроны обусловливает его применение в ядерной энергетике: из борсодержащих материалов делают регулирующие стержни ядерных реакторов.
Кристаллы бора черного цвета; они тугоплавки (т. пл. 2300 °С), диамагнитны, обладают полупроводниковыми свойствами (ширина запрещенной зоны . Электрическая проводимость бора, как и других металлов, мала и несколько возрастает при повышении температуры.
При комнатной температуре бор химически инертен и взаимодействует непосредственно только с фтором; при нагревании бор окисляется хлором, кислородом и некоторыми другими неметаллами. Например:
![]()
В соединениях с неметаллами степень окисления бора все эти соединения ковалентны.
Триоксид бора кристаллическое вещество (т. пл. 450 °С, т. кип. 2250 °С), характеризующееся высокими значениями энтальпии и энергии Гиббса образования. При взаимодействии с водой переходит в борную кислоту:
Очень слабая одноосновная кислота. Электролитическая диссоциация с отщеплением только одного иона объясняется уже описанными ранее акцепторными свойствами бора: свободная -орбиталь атома бора предоставляется электронному донору образующемуся при диссоциации молекул Процесс протекает по схеме
Комплексный анион имеет тетраэдрическую структуру (-гибридизация электронных орбиталей).
Акцепторные свойства бора в соединениях со степенью окисления проявляются и в химии его галогенидов. Так, например, легко осуществимы реакции

в которых химическая связь между и или образуется по донорно-акцепторному механизму. Свойство галогенидов бора быть акцепторами электронов обусловливает их широкое применение как катализаторов в реакциях синтеза органических соединений.
Непосредственно с водородом бор не взаимодействует, а с металлами образует бориды - обычно нестехиометрические соединения
Гидриды бора (бораны) очень ядовиты и имеют весьма неприятный запах. Их получают косвенным путем, чаще всего
при взаимодействии химически активных боридов с кислотами или галогенидов бора с гидридами щелочных металлов:
Простейшее соединение бора с водородом в обычных условиях не существует. -Гибридизация электронных орбиталей в атоме бора приводит к координационной ненасыщенности частицы вследствие чего происходит объединение двух таких частиц в молекулу диборана:
В диборане бор находится в состоянии -гибридиза-ции, причем у каждого атома бора одна из четырех гибридных орбиталей пуста, а три другие перекрыты -орбиталями атомов водорода. Связи между группами в молекуле образуются по типу водородной связи за счет смещения электронной плотности от одного атома водорода группы к пустой орбитали другой группы Известны и другие бораны, которые можно представить двумя рядами
Бориды -металлов химически активны и часто используются для получения смеси боранов при обработке кислотами. Большинство боридов и жаростойки, очень тверды, химически устойчивы. Их широко используют непосредственно в виде сплавов для изготовления деталей реактивных двигателей, лопаток газовых турбин. Некоторые бориды применяют для изготовления катодов электронных приборов.
Алюминий. Электронная конфигурация атома алюминия выражается формулой На внешнем электронном слое атома есть один неспаренный электрон:

Поэтому алюминий может проявлять валентность, равную единице. Однако эта валентность для алюминия не характерна. Во всех устойчивых соединениях степень окисления алюминия равна Валентность, равная трем, отвечает возбужденному состоянию атома

По своей распространенности алюминий занимает четвертое место среди всех элементов (после О, Н и Si) и является самым распространенным в природе металлом. Основная масса алюминия сосредоточена в алюмосиликатах: полевых шпатах, слюдах и др.
Алюминий - серебристо-белый легкий и чрезвычайно пластичный металл, обладающий высокой теплопроводностью и электрической проводимостью.
Алюминий химически активен; с хлором и бромом он реагирует при комнатной температуре, а с иодом - при нагревании или в присутствии воды как катализатора. При 800 °С алюминий взаимодействует с азотом, а при 2000 °С - с углеродом. Алюминий проявляет высокое химическое сродство к кислороду :
На воздухе алюминий покрывается очень прочной тончайшей оксидной пленкой, которая несколько ослабляет металлический блеск алюминия. Благодаря оксидной пленке поверхность алюминия приобретает высокую коррозионную стойкость. Это прежде всего проявляется в индифферентности алюминия к воде и водяному пару. Вследствие образования защитной пленки алюминий устойчив по отношению к концентрированным азотной и серной кислотам. Эти кислоты на холоду пассивируют алюминий. Склонность к пассивированию позволяет повышать коррозионную стойкость алюминия путем обработки его поверхности сильными окислителями (например, ) или с помощью анодного окисления. При этом толщина оксидной пленки возрастает до При высоких температурах прочность защитной пленки резко снижается. Если механическим воздействием снять оксидную пленку, алюминий становится крайне реакционноспособным. Он энергично взаимодействует с водой и водными растворами кислот и щелочей, вытесняя водород и образуя катионы или анионы. Взаимодействие алюминия с растворами кислот протекает по уравнению реакции
а с растворами щелочей
Катионы и анионы алюминия легко переходят друг в друга при изменении pH раствора:
В растворе могут образовываться и смешанные соединения,
например
Последнее легко (особенно при нагревании) дегидратируется и переходит в гидроксид
Широчайшее применение алюминия в технике основано на его ценных физических и химических свойствах и большой распространенности в земной коре. Вследствие высокой электрической проводимости и малой плотности он
используется для изготовления электрических проводов. Высокая пластичность алюминия позволяет изготовлять из него тончайшую фольгу, которую применяют в конденсаторах и заменяют алюминием свинец в оболочках кабелей. Из-за ненамагничиваемости сплавы алюминия применяются в радиотехнике.
Основная масса алюминия используется для получения легких сплавов - дуралюмина остальное силумина остальное и др. Алюминий применяется, кроме того, как легирующая добавка к сплавам для придания им жаростойкости. Алюминий и его сплавы занимают одно из главных мест как конструкционные материалы в самолетостроении, ракетостроении, машиностроении и т. п. Коррозионная стойкость алюминия (особенно анодированного) значительно превосходит коррозионную стойкость стали. Поэтому его сплавы используются как конструкционные материалы и в судостроении. С d-элеметами алюминий образует химические соединения - интерметаллиды (алюминиды): и др., которые используются в качестве жаропрочных материалов. Алюминий применяется в алюминотермии для получения ряда металлов и для сварки термитным методом. Алюминотермия основана на высоком сродстве алюминия к кислороду. Например, в реакции, протекающей по уравнению
выделяется около 3500 кДж теплоты и развивается температура до
Оксид алюминия известен в виде нескольких модификаций. Наиболее устойчивой является Эта модификация встречается в земной коре в виде минерала корунда, из которого готовят шлифовальные диски и наждачные порошки. Применение корунда в качестве абразивного материала основано на его высокой твердости, уступающей лишь твердости алмаза, карборунда и боразона Сплавлением получают искусственные рубины. Из них изготовляют опорные камни в точных механизмах. В последнее время искусственные рубины применяют в квантовых генераторах (лазерах). Изделия из используют как огнеупоры и диэлектрики.
Гидроксид алюминия - полимерное соединение. Он имеет слоистую кристаллическую решетку. Каждый слой состоит из октаэдров (рис. IX. 10); между слоями действует водородная связь. Получаемый по обменной реакции гидроксид алюминия - студенистый белый осадок, хорошо растворимый в кислотах и щелочах. При стоянии осадок «стареет» и теряет свою химическую активность. При прокаливании гидроксид теряет воду и переходит в оксид Одна из форм дегидратированного гидроксида - алюмогель используется в технике в качестве адсорбента.
Чрезвычайно большой интерес представляют соединения

Рис. IX. 10. Структура слоя, образованного октаэдрическими структурными единицами соединением
алюминия - цеолиты, относящиеся к алюмосиликатам. Их состав может быть выражен общей формулой где или (реже ).
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Третья группа периодической системы охватывает очень большое число химических элементов, так как в состав ее, кроме элементов главной и побочной подгрупп, входят элементы с порядковыми номерами 58--71 (лантаноиды) и с порядковыми номерами 90--103 (актиноиды). Мы рассмотрим лантаноиды и актиноиды вместе с элементами побочной подгруппы. алюминий галлий индий
Элементы главной подгруппы третьей группы -- бор, алюминий, галлий, индий и таллий--характеризуются наличием трех электронов в наружном электронном слое атома.
Алюминий -- основной представитель металлов главной подгруппы III группы Периодической системы. Свойства его аналогов -- галлия, индия и таллия -- напоминают свойства алюминия, поскольку все эти элементы имеют одинаковую электронную конфигурацию внешнего уровня ns 2 nр 1 и могут проявлять степень окисления +3.
Электронное строение элементов главной подгруппы III группы
Все элементы группы трехвалентны, но с увеличением атомного номера более характерной становится валентность 1 (Тl преимущественно одновалентен).
В ряду В--Аl--Gа--In--Тl уменьшается кислотность и увеличивается основность гидроксидов R(ОН) 3 . Н 3 ВО 3 -- кислота, Аl(ОН) 3 и Gа(ОН) 3 -- амфотерные основания, In(ОН) 3 и Тl(ОН) 3 -- типичные основания. ТlOН -- сильное основание.
Далее рассмотрим свойства элементов: подробно -- алюминия, как типичного представителя р-металлов, чрезвычайно широко применяемого на практике, бора, как представителя «полуметаллов» и проявляющего аномальные свойства по сравнению со всеми другими элементами подгруппы.
Алюминий - самый распространенный металл на Земле (3-е место среди всех элементов; 8% состава земной коры). В виде свободного металла в природе не встречается; входит в состав глиноземов (Аl 2 О 3), бокситов (Аl 2 О 3 * xН 2 О). Кроме того, алюминий обнаруживается в виде силикатов в таких породах, как глины, слюды и полевые шпаты.
Физические свойства.
Алюминий в свободном виде -- серебристо-белый металл, обладающий высокой тепло- и электропроводностью. Алюминий имеет невысокую плотность -- примерно втрое меньше, чем у железа или меди, и одновременно -- это прочный металл.
Бор существует в нескольких аллотропных модификациях. Аморфный бор представляет собой темно-коричневый порошок. Кристаллический бор -- серо-черный, с металлическим блеском. По твердости кристаллический бор занимает второе место (после алмаза) среди всех веществ. При комнатной температуре бор плохо проводит электрический ток; так же, как кремний, он обладает полупроводниковыми свойствами.
Химические свойства.
Поверхность алюминия обычно покрыта прочной пленкой оксида Аl 2 О 3 , которая предохраняет его от взаимодействия с окружающей средой. Если эту пленку удаляют, то металл может энергично реагировать с водой:
2Аl + 6Н 2 О = 2Аl(ОН) 3 + ЗН 2 ^.
В виде стружек или порошка он ярко горит на воздухе, выделяя большое количество теплоты:
2Аl + 3/2O 2 = Аl 2 О 3 + 1676 кДж.
Это обстоятельство используется для получения ряда металлов из их оксидов методом алюмотермии. Так назвали восстановление порошкообразным алюминием тех металлов, у которых теплоты образования оксидов меньше теплоты образования Аl 2 О 3 , например:
Сr 2 О 3 + 2Аl = 2Сr + Аl 2 О 3 + 539 кДж.
Бор, в отличие от алюминия, химически инертен (особенно кристаллический). Так, с кислородом он реагирует только при очень высоких температурах (> 700°С) с образованием борного ангидрида В 2 О 3:
2В + ЗО 2 = 2В 2 О 3 ,
с водой бор не реагирует ни при каких обстоятельствах. При еще более высокой температуре (> 1200°С) он взаимодействует с азотом, давая нитрид бора (служит для изготовления огнеупорных материалов):
Лишь со фтором бор реагирует при комнатной температуре, реакции же с хлором и бромом протекают только при сильном нагревании (400 и 600 °С соответственно); во всех этих случаях он образует тригалогениды ВНal 3 -- дымящие на воздухе летучие жидкости, легко гидролизующиеся водой:
2В + 3Наl 2 = 2ВНаl 3 .
В результате гидролиза образуется ортоборная (борная) кислота H 3 BO 3:
ВНаl 3 + 3Н 2 О = Н 3 ВО 3 + ЗННаl.
В отличие от бора, алюминий уже при комнатной температуре активно реагирует со всеми галогенами, образуя галогениды. При нагревании он взаимодействует с серой (200 °С), азотом (800 °С), фосфором (500 °С) и углеродом (2000 °С):
2Аl + 3S = Аl 2 S 3 (сульфид алюминия),
2Аl + N 2 = 2АlN (нитрид алюминия),
Аl + Р = АlР (фосфид алюминия),
4Аl + 3С = Аl 4 С 3 (карбид алюминия).
Все эти соединения полностью гидролизуются с образованием гидроксида алюминия и, соответственно, сероводорода, аммиака, фосфина и метана.
Алюминий легко растворяется в соляной кислоте любой концентрации:
2Аl + 6НСl = 2АlСl 3 + ЗН 2 ^.
Концентрированные серная и азотная кислоты на холоде не действуют на алюминий. При нагревании алюминий способен восстанавливать эти кислоты без выделения водорода:
2Аl + 6Н 2 SО 4(конц) = Аl 2 (SО 4) 3 + 3SО 2 + 6Н 2 О,
Аl + 6НNO 3(конц) = Аl(NO 3) 3 + 3NO 2 + 3Н 2 О.
В разбавленной серной кислоте алюминий растворяется с выделением водорода:
2Аl + 3Н 2 SО 4 = Аl 2 (SО 4) 3 + 3Н 2 .
В разбавленной азотной кислоте реакция идет с выделением оксида азота (II):
Аl + 4HNО 3 = Аl(NО 3) 3 + NO + 2Н 2 О.
Алюминий растворяется в растворах щелочей и карбонатов щелочных металлов с образованием тетрагидроксоалюминатов:
2Аl + 2NаОН + 6Н 2 О = 2Na[Аl(ОН) 4 ] + 3Н 2 ^.
Кислоты, не являющиеся окислителями, с бором не реагируют и только концентрированная HNO 3 окисляет его до борной кислоты:
В + HNO 3(конц) + Н 2 О = Н 3 ВO 3 + NO^.
Галлий (лат. Gallium), Ga, химический элемент III группы периодической системы Д. И. Менделеева, порядковый номер 31, атомная масса 69,72; серебристо-белый мягкий металл. Состоит из двух стабильных изотопов с массовыми числами 69 (60,5%) и 71 (39,5%).
Существование Галлия ("экаалюминия") и основные его свойства были предсказаны в 1870 году Д. И. Менделеевым. Элемент был открыт спектральным анализом в пиренейской цинковой обманке и выделен в 1875 году французским химиком П. Э. Лекоком де Буабодраном; назван в честь Франции (лат. Gallia). Точное совпадение свойств Галлия с предсказанными было первым триумфом периодической системы.
Среднее содержание Галлия в земной коре относительно высокое, 1,5·10 -3 % по массе, что равно содержанию свинца и молибдена. Галлий - типичный рассеянный элемент. Единственный минерал Галлия - галлит CuGaS 2 очень редок. Геохимия Галлия тесно связана с геохимией алюминия, что обусловлено сходством их физико-химических свойств. Основная часть Галлия в литосфере заключена в минералах алюминия. Содержание Галлия в бокситах и нефелинах колеблется от 0,002 до 0,01%. Повышенные концентрации Галлия наблюдаются также в сфалеритах (0,01-0,02%), в каменных углях (вместе с германием), а также в некоторых железных рудах.
Физические свойства Галлия. Галлий имеет ромбическую (псевдотетрагональную) решетку с параметрами а = 4,5197Е, b = 7,6601Е, c = 4,5257Е. Плотность (г/см 3) твердого металла 5,904 (20°С), жидкого 6,095 (29,8°С), то есть при затвердевании объем Галлия увеличивается; t пл 29,8°C, t кип 2230°С. Отличительная особенность Галлия - большой интервал жидкого состояния (2200°С) и низкое давление пара при температурах до 1100-1200°С. Удельная теплоемкость твердого Галлия 376,7 дж/(кг·К), то есть 0,09 кал/(г·град) в интервале 0-24°С, жидкого соответственно 410 дж/(кг·К), то есть 0,098 кал/(г·град) в интервале 29-100°С. Удельное электрическое сопротивление (ом·см) твердого Галлия 53,4·10 -6 (0°С), жидкого 27,2·10 -6 (30°С). Вязкость (пуаз = 0,1 н·сек/м 2): 1,612 (98°С), 0,578 (1100°С), поверхностное натяжение 0,735 н/м (735 дин/см) (30 °С в атмосфере Н 2). Коэффициенты отражения для длин волн 4360Е и 5890Е соответственно равны 75,6% и 71,3%. Сечение захвата тепловых нейтронов 2,71 барна (2,7·10 -28 м 2).
Химические свойства Галлия.
На воздухе при обычной температуре Галлий стоек. Выше 260° С в сухом кислороде наблюдается медленное окисление (пленка оксида защищает металл). В серной и соляной кислотах Галлий растворяется медленно, в плавиковой - быстро, в азотной кислоте на холоду Галлий устойчив. В горячих растворах щелочей Галлий медленно растворяется. Хлор и бром реагируют с Галлием на холоду, иод - при нагревании. Расплавленный Галлий при температурах выше 300° С взаимодействует со всеми конструкционными металлами и сплавами.
Наиболее устойчивы трехвалентные соединения Галлия, которые во многом близки по свойствам химическим соединениям алюминия. Кроме того, известны одно- и двухвалентные соединения. Высший оксид Gа 2 О 3 - вещество белого цвета, нерастворимое в воде. Соответствующий ему гидрооксид осаждается из растворов солей Галлия в виде белого студенистого осадка. Она имеет ярко выраженный амфотерный характер. При растворении в щелочах образуются галлаты (например, Na), при растворении в кислотах - соли Галлия: Gа 2 (SО 4) 3 , GaCl 3 и др. Кислотные свойства у гидрооксида Галлия выражены сильнее, чем у гидрооксида алюминия [интервал выделения Аl(ОН) 3 лежит в пределах рН = 10,6-4,1, a Ga(OH) 3 в пределах рН = 9,7-3,4].
В отличие от Al(ОН) 3 , гидрооксид Галлия растворяется не только в сильных щелочах, но и в растворах аммиака. При кипячении из аммиачного раствора вновь выпадает гидрооксид Галлия.
Из солей Галлия наибольшее значение имеют хлорид GaCl 3 (t пл 78°C, t кип 200°C) и сульфат Ga 2 (SO 4) 3 . Последний с сульфатами щелочных металлов и аммония образует двойные соли типа квасцов, например (NH 4)Ga(SO 4) 2 ·12H 2 O. Галлий образует малорастворимый в воде и разбавленных кислотах ферроцианид Ga 4 3 , что может быть использовано для его отделения от Аl и ряда других элементов.
Получение Галлия. Основной источник получения Галлия - алюминиевое производство. Галлий при переработке бокситов по способу Байера концентрируется в оборотных маточных растворах после выделения Аl(ОН) 3 . Из таких растворов Галлий выделяют электролизом на ртутном катоде. Из щелочного раствора, полученного после обработки амальгамы водой, осаждают Ga(OH) 3 , которую растворяют в щелочи и выделяют Галлий электролизом.
При содово-известковом способе переработки бокситовой или нефелиновой руды Галлий концентрируется в последних фракциях осадков, выделяемых в процессе карбонизации. Для дополнительного обогащения осадок гидрооксидов обрабатывают известковым молоком. При этом большая часть Al остается в осадке, а Галлий переходит в раствор, из которого пропусканием СО 2 выделяют галлиевый концентрат (6-8% Gа 2 О 3); последний растворяют в щелочи и выделяют Галлий электролитически.
Источником Галлия может служить также остаточный анодный сплав процесса рафинирования Al по методу трехслойного электролиза. В производстве цинка источниками Галлия являются возгоны (вельц-оксиды), образующиеся при переработке хвостов выщелачивания цинковых огарков.
Полученный электролизом щелочного раствора жидкий Галлий, промытый водой и кислотами (НСl, HNO 3), содержит 99,9-99,95% Ga. Более чистый металл получают плавкой в вакууме, зонной плавкой или вытягиванием монокристалла из расплава.
Применение Галлия. Наиболее перспективно применение Галлия в виде химических соединений типа GaAs, GaP, GaSb, обладающих полупроводниковыми свойствами. Они могут применяться в высокотемпературных выпрямителях и транзисторах, солнечных батареях и других приборах, где может быть использован фотоэффект в запирающем слое, а также в приемниках инфракрасного излучения. Галлий можно использовать для изготовления оптических зеркал, отличающихся высокой отражательной способностью. Сплав алюминия с Галлием предложен вместо ртути в качестве катода ламп ультрафиолетового излучения, применяемых в медицине. Жидкий Галлий и его сплавы предложено использовать для изготовления высокотемпературных термометров (600-1300°С) и манометров. Представляет интерес применение Галлия и его сплавов в качестве жидкого теплоносителя в энергетических ядерных реакторах (этому мешает активное взаимодействие Галлий при рабочих температурах с конструкционными материалами; эвтектический сплав Ga-Zn-Sn оказывает меньшее коррозионное действие, чем чистый Галлий).
Индий (лат. Indium), In, химический элемент III группы периодической системы Менделеева; атомный номер 49, атомная масса 114,82; белый блестящий мягкий металл. Элемент состоит из смеси двух изотопов: 113 In (4,33%) и 115 In (95,67%); последний изотоп обладает очень слабой в-радиоактивностью (период полураспада T Ѕ = 6·10 14 лет).
В 1863 году немецкие ученые Ф. Райх и T. Рихтер при спектроскопическом исследовании цинковой обманки обнаружили в спектре новые линии, принадлежащие неизвестному элементу. По ярко-синей (цвета индиго) окраске этих линий новый элемент был назван Индий.
Распространение Индия в природе. Индий - типичный рассеянный элемент, его среднее содержание в литосфере составляет 1,4·10 -5 % по массе. При магматических процессах происходит слабое накопление Индия в гранитах и других кислых породах. Главные процессы концентрации Индия в земной коре связаны с горячими водными растворами, образующими гидротермальные месторождения. Индий связан в них с Zn, Sn, Cd и Pb. Сфалериты, халькопириты и касситериты обогащены Индием в среднем в 100 раз (содержание около l,4·10 -3 %). Известны три минерала Индия - самородный Индий, рокезит CuInS 2 и индит In 2 S 4 , но все они крайне редкие. Практическое значение имеет накопление Индия в сфалеритах (до 0,1%, иногда 1%). Обогащение Индия характерно для месторождений Тихоокеанского рудного пояса.
Физические свойства Индия .
Кристаллическая решетка Индия тетрагональная гранецентрированная с параметрами а = 4,583Е и с= 4,936Е. Атомный радиус 1,66Е; ионные радиусы In 3+ 0,92Е, In + 1,30Е; плотность 7,362 г/см 3 . Индий легкоплавок, его t пл 156,2 °C; t кип 2075 °C. Температурный коэффициент линейного расширения 33·10 -6 (20 °С); удельная теплоемкость при 0-150°С 234,461 дж/(кг·К), или 0,056 кал/(г·° С); удельное электросопротивление при 0°C 8,2·10 -8 ом·м, или 8,2·10 -6 ом·см; модуль упругости 11 н/м 2 , или 1100 кгс/мм 2 ; твердость по Бринеллю 9 Мн/м 2 , или 0,9 кгс/мм 2 .
Химические свойства Индия .
В соответствии с электронной конфигурацией атома 4d 10 5s 2 5p 1 Индий в соединениях проявляет валентность 1, 2 и 3 (преимущественно). На воздухе в твердом компактном состоянии Индий стоек, но окисляется при высоких температурах, а выше 800 °C горит фиолетово-синим пламенем, давая оксид In 2 O 3 - желтые кристаллы, хорошо растворимые в кислотах. При нагревании Индий легко соединяется с галогенами, образуя растворимые галогениды InCl 3 , InBr 3 , InI 3 . Нагреванием Индия в токе HCl получают хлорид InCl 2 , а при пропускании паров InCl 2 над нагретым In образуется InCl. С серой Индий образует сульфиды In 2 S 3 , InS; они дают соединения InS·In 2 S 3 и 3InS·In 2 S 3 . В воде в присутствии окислителей Индий медленно корродирует с поверхности: 4In + 3O 2 +6H 2 O = 4In(ОН) 3 . В кислотах Индий растворим, его нормальный электродный потенциал равен -0,34 в, в щелочах практически не растворяется. Соли Индия легко гидролизуются; продукт гидролиза - основные соли или гидрооксид In(OH) 3 . Последний хорошо растворим в кислотах и плохо - в растворах щелочей (с образованием солей - индатов): In(ОН) 3 + 3KOH = K 3 . Соединения Индия низших степеней окисления довольно неустойчивы; галогениды InHal и черный оксид In 2 O - очень сильные восстановители.
Получение Индия.
Индий получают из отходов и промежуточных продуктов производств цинка, свинца и олова. Это сырье содержит от тысячных до десятых долей процента Индия. Извлечение Индия складывается из трех основные этапов: получение обогащенного продукта - концентрата Индия; переработка концентрата до чернового металла; рафинирование. В большинстве случаев исходное сырье обрабатывают серной кислотой и переводят Индий в раствор, из которого гидролитическим осаждением выделяют концентрат. Черновой Индий выделяют главным образом цементацией на цинке или алюминии. Рафинирование производят химическими, электрохимическими, дистилляционными и кристаллофизическими методами.
Применение Индия .
Наиболее широко Индий и его соединения (например, нитрид InN, фосфид InP, антимонид InSb) применяют в полупроводниковой технике. Индий служит для различных антикоррозионных покрытий (в т. ч. подшипниковых). Индиевые покрытия обладают высокой отражательной способностью, что используется для изготовления зеркал и рефлекторов. Промышленное значение имеют некоторые сплавы Индий, в том числе легкоплавкие сплавы, припои для склеивания стекла с металлом и другие.
Таллий (лат. Thallium), Tl, химический элемент III группы периодической системы Менделеева, атомный номер 81, атомная масса 204,37; на свежем разрезе серый блестящий металл; относится к редким рассеянным элементам. В природе элемент представлен двумя стабильными изотопами 203 Tl (29,5%) и 205 Tl (70,5%) и радиоактивными изотопами 207 Tl - 210 Tl - членами радиоактивных рядов. Искусственно получены радиоактивные изотопы 202 Tl (Т Ѕ = 12,5 сут), 204 Tl (T Ѕ = 4,26 года), 206 Tl (Т Ѕ = 4,19 мин) и другие. Таллий открыт в 1861году У. Круксом в шламе сернокислотного производства спектроскопическим методом по характерной зеленой линии в спектре (отсюда название: от греч. thallos - молодая, зеленая ветка). В 1862 году французский химик К. О. Лами впервые выделил Таллий и установил его металлическую природу.
Распространение Таллия в природе. Среднее содержание Таллия в земной коре (кларк) 4,5·10 -5 % по массе, но благодаря крайнему рассеянию его роль в природных процессах невелика. В природе встречаются преимущественно соединения одновалентного и реже трехвалентного Таллия. Как и щелочные металлы, Таллий концентрируется в верхней части земной коры - в гранитном слое (среднее содержание 1,5·10 -4 %), в основные породах его меньше (2·10 -5 %), а в ультраосновных лишь 1·10 -6 %. Известно лишь семь минералов Таллия (например, круксит, лорандит, врбаит и другие), все они крайне редкие. Наибольшее геохимическое сходство Таллий имеет с К, Rb, Cs, а также с Pb, Ag, Cu, Bi. Таллий легко мигрирует в биосфере. Из природных вод он сорбируется углями, глинами, гидрооксидами марганца, накапливается при испарении воды (например, в озере Сиваш до 5·10 -8 г/л).
Физические свойства Таллия
Таллий мягкий металл, на воздухе легко окисляется и быстро тускнеет. Таллий при давлении 0,1 Мн/м 2 (1 кгс/см 2) и температуре ниже 233 °С имеет гексагональную плотноупакованную решетку (а=3,4496Е; с = 5,5137Е), выше 233 °С - объемноцентрированную кубическую (а = 4,841Е), при высоких давлениях 3,9 Гн/м 2 (39000 кгс/см 2) - гранецентрированную кубическую; плотность 11,85г/см 3 ; атомный радиус 1,71Е, ионные радиусы: Tl + 1,49 Е, Tl 3+ 1,05 Е; Т пл 303,6 °С; Т кип 1457 °С, удельная теплоемкость 0,130 кдж/(кг·К) при 20-100 °С; температурный коэффициент линейного расширения 28·10 -6 при 20 °С и 41,5·10 -6 при 240-280 °С; теплопроводность 38,94 вт/(м -К) . Удельное электросопротивление при 0 °С (18·10 -6 ом -см); температурный коэффициент электросопротивления 5,177·10 -3 - 3,98·10 -3 (0-100 °С). Температура перехода в сверхпроводящее состояние 2,39 К. Таллий диамагнитен, его удельная магнитная восприимчивость -0,249·10 -6 (30 °С).
Химические свойства Таллия.
Конфигурация внешней электронной оболочки атома Tl 6s 2 6р 1 ; в соединениях имеет степень окисления +1 и +3 . Таллий взаимодействует с кислородом и галогенами уже при комнатной температуре, с серой и фосфором при нагревании. Хорошо растворяется в азотной, хуже в серной кислотах, не растворяется в галогенводородных, муравьиной, щавелевой и уксусной кислотах. Не взаимодействует с растворами щелочей; свежеперегнанная вода, не содержащая кислорода, не действует на Таллий. Основные соединения с кислородом: оксид (I) Tl 2 О и оксид (III) Tl 2 О 3 . Оксид Таллия (I) и соли Tl (I) нитрат, сульфат, карбонат - растворимы; хромат, бихромат, галогениды (за исключением фторида), а также оксид Таллия (III) - малорастворимы в воде. Tl (Ш) образует большое число комплексных соединений с неорганических и органических лигандами. Галогениды Tl (Ш) хорошо растворимы в воде. Наибольшее практическое значение имеют соединения Tl (I).
Получение Таллия .
В промышленного масштабах технический Таллий получают попутно при переработке сульфидных руд цветных металлов и железа. Его извлекают из полупродуктов свинцового, цинкового и медного производств. Выбор способа переработки сырья зависит от его состава. Например, для извлечения Таллия и других ценных компонентов из пылей свинцового производства проводится сульфатизация материала в кипящем слое при 300-350 °С. Полученную сульфатную массу выщелачивают водой, и из раствора экстрагируют Таллий 50%-ным раствором трибутилфосфата в керосине, содержащим иод, а затем реэкстрагируют серной кислотой (300 г/л) с добавкой 3%-ной перекиси водорода. Из реэкстрактов металл выделяют цементацией на цинковых листах. После переплавки под слоем едкого натра получают Таллий чистотой 99,99%. Для более глубокой очистки металла применяют электролитическое рафинирование и кристаллизационную очистку. алюминий, галлий, индий
Применение Таллия.
В технике Таллий применяется главным образом в виде соединений. Монокристаллы твердых растворов галогенидов TlBr - TlI и TlCl - TlBr (известные в технике как КРС-5 и КРС-6) используют для изготовления оптических деталей в приборах инфракрасной техники; кристаллы TlCl и TlCl-TlBr- в качестве радиаторов счетчиков Черенкова. Tl 2 О входит в состав некоторых оптических стекол; сульфиды, оксисульфиды, селениды, теллуриды - компоненты полупроводниковых материалов, использующихся при изготовлении фотосопротивлений, полупроводниковых выпрямителей, видиконов. Водный раствор смеси муравьино- и малоновокислого Таллия (тяжелая жидкость Клеричи) широко применяют для разделения минералов по плотности. Амальгама Таллия, затвердевающая при -59°С, применяется в низкотемпературных термометрах. Металлический Таллий используют для получения подшипниковых и легкоплавких сплавов, а также в кислородомерах для определения кислорода в воде. 204 Tl в качестве источника в-излучений применяют в радиоизотопных приборах.
Бор (лат. Borum), В, химический элемент III группы периодической системы Менделеева, атомный номер 5, атомная масса 10,811; кристаллы серовато-черного цвета (очень чистый Бор бесцветен). Природный Бор состоит из двух стабильных изотопов: 10 B (19%) и 11 B (81%).
Ранее других известное соединение Бора - бура - упоминается в сочинениях алхимиков под арабским названием "бурак" и латинским Borax, откуда и произошло наименование "бор". Свободный Бор (нечистый) впервые получили французские химики Ж. Гей-Люссак и Л. Тенар в 1808 году нагреванием борного ангидрида B 2 O 3 с металлическим калием. Общее содержание Бора в земной коре 3·10 -4 % по массе. В природе Бор в свободном состоянии не обнаружен. Многие соединения Бора широко распространены, особенно в небольших концентрациях. В виде боросиликатов, боратов, бороалюмосиликатов, а также как изоморфная примесь в других минералах Бор входит в состав многих изверженных и осадочных пород. Соединения Бора найдены в нефтяных водах, морской воде, соляных озерах, горячих источниках, в вулканических и сопочных грязях, во многих почвах.
Физические свойства Бора .
Известно несколько кристаллических модификаций Бор Для двух из них рентгеноструктурным анализом удалось полностью определить кристаллическую структуру, которая в обоих случаях оказалась весьма сложной. Атомы Бора образуют в этих структурах трехмерный каркас подобно атомам углерода в алмазе. Этим объясняется высокая твердость Бора. Однако строение каркаса в структурах Бора гораздо сложнее, чем в алмазе. Основной структурной единицей в кристаллах Бора служат двадцатигранники (икосаэдры), в вершинах каждого из которых находятся 12 атомов Бора. Икосаэдры соединяются между собой как непосредственно, так и посредством промежуточных атомов Бора, не входящих в состав какого-либо икосаэдра. При таком строении оказывается, что атомы Бор в кристаллах имеют разные координационные числа: 4, 5, 6 и 5 + 2 (5 ближних "соседей" и 2 более далеких). Так как на внешней оболочке атома Бора находятся всего 3 электрона (электронная конфигурация 2s 2 2p 1), на каждую присутствующую в кристаллическом Боре связь приходится существенно меньше двух электронов. В соответствии с современными представлениями, в кристаллах Бор осуществляется особый тип ковалентной связи - многоцентровая связь с дефицитом электронов. В соединениях ионного типа Бор 3-валентен. Так называемый "аморфный" Бор, получаемый при восстановлении B 2 O 3 металлическим натрием или калием, имеет плотность 1,73 г/см 3 . Чистый кристаллический Бор имеет плотность 2,3 г/см 3 , температуру плавления 2030°С, температуру кипения 3860°С; твердость Бора по минералогической шкале 9, микротвердость 34 Гн/м 2 (3400 кгс/мм 2). Кристаллический Бор - полупроводник. В обычных условиях он проводит электрический ток плохо. При нагревании до 800°С электрическая проводимость Бора увеличивается на несколько порядков, причем знак проводимости меняется (электронная - при низких температурах, дырочная - при высоких).
Химические свойства Бора.
Химически Бор при обычных условиях довольно инертен (взаимодействует активно лишь с фтором), причем кристаллический Бор менее активен, чем аморфный. С повышением температуры активность Бора возрастает и он соединяется с кислородом, серой, галогенами. При нагревании на воздухе до 700°С Бор горит красноватым пламенем, образуя борный ангидрид B 2 O 3 - бесцветную стекловидную массу. При нагревании выше 900 °С Бор с азотом образует нитрид бора BN, при нагревании с углем -карбид бора B 4 C 3 , с металлами - бориды. С водородом Бор заметно не реагирует; его гидриды (бороводороды) получают косвенным путем. При температуре красного каления Бор взаимодействует с водяным паром: 2B + 3Н 2 О = B 2 O 3 + 3H 2 . В кислотах Бор при обычной температуре не растворяется, кроме концентрированной азотной кислоты, которая окисляет его до борной кислоты H 3 BO 3 . Медленно растворяется в концентрированных растворах щелочей с образованием боратов.
Во фториде BF 3 и других галогенидах Бор связан с галогенами тремя ковалентными связями. Поскольку для завершения устойчивой 8-электронной оболочки атому Бора в галогениде BX 3 недостает пары электронов, молекулы галогенидов, особенно BF 3 , присоединяют молекулы других веществ, имеющие свободные электронные пары, например аммиака.
В таких комплексных соединениях атом Бор окружен четырьмя атомами (или группами атомов), что соответствует характерному для Бора в его соединениях координационному числу 4. Важные комплексные соединения Бор - борогидриды, например Na, и фтороборная, или борофтористоводородная, кислота H , образующаяся из BF 3 и HF; большинство солей этой кислоты (фтороборатов) растворимы в воде (за исключением солей К, Rb, Cs). Общая особенность самого Бора и его соединений - их сходство с кремнием и его соединениями. Так, борная кислота, подобно кремниевой, обладает слабыми кислотными свойствами и растворяется в HF с образованием газообразного BF 3 (кремниевая дает SiF 4). Бороводороды напоминают кремневодороды, а карбид Бора - карбид кремния, и т. д. Представляет интерес особое сходство модификаций нитрида BN с графитом или алмазом. Это связано с тем, что атомы В и N по электронной конфигурации совместно имитируют 2 атома С (у В - 3 валентных электрона, у N - 5, у двух атомов С - по 4). Эта аналогия характерна и для других соединений, содержащих одновременно Бор и азот. Так, боразан ВН 3 -NH 3 подобен этану СН 3 -СН 3 , а боразен BH 2 =NH 2 и простейший боразин BH?NH подобны соответственно этилену СН 2 =СН 2 и ацетилену СН?СН. Если тримеризация ацетилена С 2 Н 2 дает бензол С 6 Н 6 , то аналогичный процесс приводит от боразина BHNH к боразолу B 3 N 3 H 6 .
Получение Бора .
Элементарный Бор из природного сырья получают в несколько стадий. Разложением боратов горячей водой или серной кислотой (в зависимости от их растворимости) получают борную кислоту, а ее обезвоживанием - борный ангидрид. Восстановление В 2 О 3 металлическим магнием дает Бор в виде темно-бурого порошка; от примесей его очищают обработкой азотной и плавиковой кислотами. Очень чистый Бор, необходимый в производстве полупроводников, получают из его галогенидов: восстанавливают ВCl 3 водородом при 1200°С или разлагают пары ВВr 3 на танталовой проволоке, раскаленной до 1500°С. Чистый Бор получают также термическим разложением бороводородов.
Применение Бора. Бор в небольших количествах (доли%) вводят в сталь и некоторые сплавы для улучшения их механических свойств; уже присадка к стали 0,001-0,003% Бор повышает ее прочность (обычно в сталь вводят Бор в виде ферробора, то есть сплава железа с 10-20% Бора). Поверхностное насыщение стальных деталей бором (до глубины 0,1-0,5 мм) улучшает не только механические свойства, но и стойкость стали против коррозии. Благодаря способности изотопа 10 В поглощать тепловые нейтроны, его применяют для изготовления регулирующих стержней ядерных реакторов, служащих для прекращения или замедления реакции деления. Бор в виде газообразного BF 3 используют в счетчиках нейтронов. (При взаимодействии ядер 10 В с нейтронами образуются заряженные б-частицы, которые легко регистрировать; число же б-частиц равно числу нейтронов, поступивших в счетчик: 10 5 В + 1 0 n = 7 3 Li + 4 2 б). Сам Бор и его соединения - нитрид BN, карбид B 4 C 3 , фосфид ВР и другие - применяют как диэлектрики и полупроводниковые материалы. Обширное применение находят борная кислота и ее соли (прежде всего бура), бориды и другие. BF 3 - катализатор некоторых органических реакций.
Бор в организме
. Бор относится к числу химических элементов, которые в очень малых количествах содержатся в тканях растений и животных (тысячные и десятитысячные доли% на сухую массу). Бор необходим для поддержания нормальной жизнедеятельности растений. Важнейший симптом недостатка Бора - отмирание точки роста главного стебля, а затем и пазушных почек. Одновременно черешки и листья становятся хрупкими, цветки не появляются или не образуются плоды; поэтому при недостатке Бора падает урожай семян. Известны многие болезни, связанные с недостатком Бора, например гниль сердечка сахарной свеклы, черная пятнистость столовой свеклы, побурение сердцевины брюквы и цветной капусты, засыхание верхушки льна, желтуха верхушки люцерны, бурая пятнистость абрикосов, опробковение яблок. При недостатке Бора замедляется окисление сахаров, аминирование продуктов углеводного обмена, синтез клеточных белков; однако ферменты, для которых Бор является необходимым элементом, пока неизвестны. При недостатке Бора у растений снижается содержание аденозинтрифосфорной кислоты, а также нарушается процесс окислительного фосфорилирования, вследствие чего энергия, выделяющаяся при дыхании, не может быть использована для синтеза необходимых веществ. При недостатке Бора в почве в нее вносят борные удобрения. В биогеохимических провинциях с избытком Бора в почве (например, в Северо-Западном Казахстане) возникают морфологические изменения и заболевания растений, вызываемые накоплением Бора,- гигантизм, карликовость, нарушение точек роста и других. На почвах с интенсивным борным засолением встречаются участки, лишенные растительности, "плешины", - один из поисковых признаков месторождения Бора. Значение Бора в организме животных пока не выяснено. У человека и животных (овец, верблюдов) при питании растениями с избыточным содержанием Бора (60-600 мг/кг сухого вещества и более) нарушается обмен веществ (в частности, активность протеолитических ферментов) и появляется эндемическое заболевание желудочно-кишечного тракта - борный энтерит.
Алюминий (лат. Aluminium), Al, химический элемент III группы периодической системы Менделеева; атомный номер 13, атомная масса 26,9815; серебристо-белый легкий металл. Состоит из одного стабильного изотопа 27 Al.
Историческая справка. Название Алюминий происходит от лат. alumen - так еще за 500 лет до н. э. назывались алюминиевые квасцы, которые применялись как протрава при крашении тканей и для дубления кожи. Датский ученый X. К. Эрстед в 1825, действуя амальгамой калия на безводный АlСl 3 и затем отгоняя ртуть, получил относительно чистый Алюминий. Первый промышленного способ производства Алюминия предложил в 1854 французский химик А. Э. Сент-Клер Девиль: способ заключался в восстановлении двойного хлорида Алюминия и натрия Na 3 AlCl 6 металлическим натрием. Похожий по цвету на серебро, Алюминий на первых порах ценился очень дорого. С 1855 по 1890 годы было получено всего 200 т Алюминия. Современный способ получения Алюминия электролизом криолитоглиноземного расплава разработан в 1886 году одновременно и независимо друг от друга Ч. Холлом в США и П. Эру во Франции.
Распространение Алюминия в природе. По распространенности в природе Алюминий занимает 3-е место после кислорода и кремния и 1-е - среди металлов. Его содержание в земной коре составляет по массе 8,80% . В свободном виде Алюминий в силу своей химической активности не встречается. Известно несколько сотен минералов Алюминия, преимущественно алюмосиликатов. Промышленное значение имеют боксит, алунит и нефелин. Нефелиновые породы беднее бокситов глиноземом, но при их комплексном использовании получаются важные побочные продукты: сода, поташ, серная кислота. В СССР разработан метод комплексного использования нефелинов. Нефелиновые руды в СССР образуют, в отличие от бокситов, весьма крупные месторождения и создают практически неограниченные возможности для развития алюминиевой промышленности.
Физические свойства Алюминия .
Алюминий сочетает весьма ценный комплекс свойств: малую плотность, высокие теплопроводность и электрическую проводимость, высокую пластичность и хорошую коррозионную стойкость. Он легко поддается ковке, штамповке, прокатке, волочению. Алюминий хорошо сваривается газовой, контактной и других видами сварки. Решетка Алюминия кубическая гранецентрированная с параметром а = 4,0413 Е. Свойства Алюминий, как и всех металлов, в значит, степени зависят от его чистоты. Свойства Алюминия особой чистоты (99,996%): плотность (при 20°С) 2698,9 кг/м 3 ; t пл 660,24°С; t кип около 2500°С; коэффициент термического расширения (от 20° до 100°С) 23,86·10 -6 ; теплопроводность (при 190°С) 343 вт/м·К , удельная теплоемкость (при 100°С) 931,98 дж/кг·К. ; электропроводность по отношению к меди (при 20 °С) 65,5%. Алюминий обладает невысокой прочностью (предел прочности 50-60 Мн/м 2), твердостью (170 Мн/м 2 по Бринеллю) и высокой пластичностью (до 50%). При холодной прокатке предел прочности Алюминия возрастает до 115 Мн/м 2 , твердость - до 270 Мн/м 2 , относительное удлинение снижается до 5% (1 Мн/м 2 ~ и 0,1 кгс/мм 2). Алюминий хорошо полируется, анодируется и обладает высокой отражательной способностью, близкой к серебру (он отражает до 90% падающей световой энергии). Обладая большим сродством к кислороду, Алюминий на воздухе покрывается тонкой, но очень прочной пленкой оксида Al 2 О 3 , защищающей металл от дальнейшего окисления и обусловливающей его высокие антикоррозионные свойства. Прочность оксидной пленки и защитное действие ее сильно убывают в присутствии примесей ртути, натрия, магния, меди и др. Алюминий стоек к действию атмосферной коррозии, морской и пресной воды, практически не взаимодействует с концентрированной или сильно разбавленной азотной кислотой, с органических кислотами, пищевыми продуктами.
Химические свойства Алюминия.
Внешняя электронная оболочка атома Алюминия состоит из 3 электронов и имеет строение 3s 2 3р 1 . В обычных условиях Алюминий в соединениях 3-валентен, но при высоких температурах может быть одновалентным, образуя так называемых субсоединения. Субгалогениды Алюминия, AlF и АlСl, устойчивые лишь в газообразном состоянии, в вакууме или в инертной атмосфере, при понижении температуры распадаются (диспропорционируют) на чистый Аl и AlF 3 или АlСl 3 и поэтому могут быть использованы для получения сверхчистого Алюминия. При накаливании мелкоизмельченный или порошкообразный Алюминий энергично сгорает на воздухе. Сжиганием Алюминия в токе кислорода достигается температура выше 3000°С. Свойством Алюминия активно взаимодействовать с кислородом пользуются для восстановления металлов из их оксидов (Алюминотермия). При темно-красном калении фтор энергично взаимодействует с Алюминием, образуя AlF 3 . Хлор и жидкий бром реагируют с Алюминием при комнатной температуре, иод - при нагревании. При высокой температуре Алюминий соединяется с азотом, углеродом и серой, образуя соответственно нитрид AlN, карбид Al 4 C 3 и сульфид Al 2 S 3 . С водородом Алюминий не взаимодействует; гидрид Алюминия (AlН 3) X получен косвенным путем. Большой интерес представляют двойные гидриды Алюминия и элементов I и II групп периодической системы состава МеН n · n AlH 3 , так называемые алюмогидриды. Алюминий легко растворяется в щелочах, выделяя водород и образуя алюминаты. Большинство солей Алюминия хорошо растворимо в воде. Растворы солей Алюминия вследствие гидролиза показывают кислую реакцию.
Получение Алюминия .
В промышленности Алюминий получают электролизом глинозема Аl 2 О 3 , растворенного в расплавленном криолите NasAlF 6 при температуре около 950° С. Используются электролизеры трех основных конструкций: 1) электролизеры с непрерывными самообжигающимися анодами и боковым подводом тока, 2) то же, но с верхним подводом тока и 3) электролизеры с обожженными анодами. Электролитная ванна представляет собой железный кожух, футерованный внутри тепло- и электро-изолирующим материалом - огнеупорным кирпичом, и выложенный угольными плитами и блоками. Рабочий объем заполняется расплавленным электролитом, состоящим из 6-8% глинозема и 94-92% криолита (обычно с добавкой AlF 3 и около 5-6% смеси фторидов калия и магния). Катодом служит подина ванны, анодом - погруженные в электролит угольные обожженные блоки или же набивные самообжигающиеся электроды. При прохождении тока на катоде выделяется расплавленный Алюминий, который накапливается на подине, а на аноде - кислород, образующий с угольным анодом CO и CO 2 . К глинозему, основному расходуемому материалу, предъявляются высокие требования по чистоте и размерам частиц. Присутствие в нем оксидов более электроположительных элементов, чем Алюминий, ведет к загрязнению Алюминия. При достаточном содержании глинозема ванна работает нормально при электрическом напряжении порядка 4-4,5 В. Ванны присоединяют к источнику постоянного тока последовательно (сериями из 150-160 ванн). Современные электролизеры работают при силе тока до 150 кА. Из ванн Алюминий извлекают обычно с помощью вакуум-ковша. Расплавленный Алюминий чистотой 99,7% разливают в формы. Алюминий высокой чистоты (99,9965%) получают электролитическим рафинированием первичного Алюминия с помощью так называемых трехслойного способа, снижающего содержание примесей Fe, Si и Сu. Исследования процесса электролитического рафинирования Алюминия с применением органических электролитов показали принципиальную возможность получения Алюминий чистотой 99,999% при относительно низком расходе энергии, но пока этот метод обладает низкой производительностью. Для глубокой очистки Алюминий применяют зонную плавку или дистилляцию его через субфторид.
При электролитическом производстве Алюминия возможны поражения электрическим током, высокой температурой и вредными газами. Для избежания несчастных случаев ванны надежно изолируют, рабочие пользуются сухими валенками, соответствующей спецодеждой. Здоровая атмосфера поддерживается эффективной вентиляцией. При постоянном вдыхании пыли металлического Алюминия и его оксида может возникнуть алюминоз легких. У рабочих, занятых в производстве Алюминия, часты катары верхних дыхательных путей (риниты, фарингиты, ларингиты). Предельно допустимая концентрация в воздухе пыли металлического Алюминий, его оксида и сплавов 2 мг/м 3 .
Применение Алюминия.
Сочетание физических, механических и химических свойств Алюминия определяет его широкое применение практически во всех областях техники, особенно в виде его сплавов с других металлами. В электротехнике Алюминий успешно заменяет медь, особенно в производстве массивных проводников, например, в воздушных линиях, высоковольтных кабелях, шинах распределительных устройств, трансформаторах (электрическая проводимость Алюминия достигает 65,5% электрической проводимости меди, и он более чем в три раза легче меди; при поперечном сечении, обеспечивающем одну и ту же проводимость, масса проводов из Алюминий вдвое меньше медных). Сверхчистый Алюминий употребляют в производстве электрических конденсаторов и выпрямителей, действие которых основано на способности оксидной пленки Алюминия пропускать электрический ток только в одном направлении. Сверхчистый Алюминий, очищенный зонной плавкой, применяется для синтеза полупроводниковых соединений типа А III B V ,применяемых для производства полупроводниковых приборов. Чистый Алюминий используют в производстве разного рода зеркальных отражателей. Алюминий высокой чистоты применяют для предохранения металлических поверхностей от действия атмосферной коррозии (плакирование, алюминиевая краска). Обладая относительно низким сечением поглощения нейтронов, Алюминий применяется как конструкционный материал в ядерных реакторах.
В алюминиевых резервуарах большой емкости хранят и транспортируют жидкие газы (метан, кислород, водород и т. д.), азотную и уксусную кислоты, чистую воду, перекись водорода и пищевые масла. Алюминий широко применяют в оборудовании и аппаратах пищевой промышленности, для упаковки пищевых продуктов (в виде фольги), для производства разного рода бытовых изделий. Резко возросло потребление Алюминий для отделки зданий, архитектурных, транспортных и спортивных сооружений.
В металлургии Алюминий (помимо сплавов на его основе)- одна из самых распространенных легирующих добавок в сплавах на основе Сu, Mg, Ti, Ni, Zn и Fe. Применяют Алюминий также для раскисления стали перед заливкой ее в форму, а также в процессах получения некоторых металлов методом алюминотермии. На основе Алюминия методом порошковой металлургии создан САП (спеченный алюминиевый порошок), обладающий при температурах выше 300°С большой жаропрочностью.
Алюминий используют в производстве взрывчатых веществ (аммонал, алюмотол). Широко применяют различные соединения Алюминия.
Производство и потребление Алюминия непрерывно растет, значительно опережая по темпам роста производство стали, меди, свинца, цинка.
Размещено на Allbest.ru
Подобные документы
Общая характеристика р-элементов III группы, их основные физические и химические свойства. Описание самых распространенных элементов: бора, алюминия, подгруппы галлия. Их биологическая роль, применение и распространенность. Причины парникового эффекта.
дипломная работа , добавлен 08.08.2015
Характеристика галлия как не самого легкоплавкого из металлов, температура плавления. История открытия элемента, область его применения. Попытки применения галлия в атомных реакторах. Патент на применение галлия. Взаимодействие галлия с серной кислотой.
реферат , добавлен 19.01.2010
Получение, строение и физико-химические свойства тригалогенидов галлия. Ионные и молекулярные комплексы с органическими и неорганическими лигандами. Термохимические характеристики комплексов. Синтез комплекса хлорида галлия с 1,2-бис(4-пиридил)этиленом.
курсовая работа , добавлен 05.10.2015
Физические свойства элементов главной подгруппы III группы. Общая характеристика алюминия, бора. Природные неорганические соединения углерода. Химические свойства кремния. Взаимодействие углерода с металлами, неметаллами и водой. Свойства оксидов.
презентация , добавлен 09.04.2017
История открытия химических элементов. Запасы и добыча разведанных месторождений индия и таллия. Физические и химические свойства элементов, их получение и применение. Опасность отравления таллием (солями), использование берлинской лазури как антидота.
презентация , добавлен 11.03.2014
Периодическая система Д.И. Менделеева. Характеристика химического элемента алюминия, его химические и физические свойства. Ценность "серебра из глины" в период его открытия. Способ получения алюминия, его содержание в земной коре, важнейшие минералы.
презентация , добавлен 11.11.2011
Происхождение, методы получения и физико-химические свойства висмута - химического элемента V группы периодической системы Д.И. Менделеева. Содержание в земной коре и в воде, добыча и производство. Применение в промышленности, машиностроении и в медицине.
курсовая работа , добавлен 01.05.2011
Свойства алюминия: его получение, применение и химические свойства. Виды щелочей в алюминатных растворах. Оксиды и гидроксиды алюминия. Корунд как наиболее устойчивая форма глинозёма. Природные соединения алюминия: боксит, корунд, рубин и сапфир.
реферат , добавлен 27.03.2009
Общая характеристика алюминия как элемента периодической таблицы химических элементов. Физико-химические свойства алюминия. Химический опыт с исчезновением алюминиевой ложки. Амфотерные свойства гидроксида алюминия. Необычная реакция вытеснения.
лабораторная работа , добавлен 09.06.2014
Атомные, физические и химические свойства элементов подгруппы меди и их соединений. Содержание элементов подгруппы меди в земной коре. Использование пиро- и гидрометаллургическиех процессов для получения меди. Свойства соединений меди, серебра и золота.
С увеличением атомной массы усиливается металлический характер элементов. Бор - неметалл, остальные элементы (подгруппа алюминия) - металлы. Бор значительно отличается по свойствам от остальных элементов и больше похож на углерод и кремний. Остальные элементы - легкоплавкие металлы, In и Тl - чрезвычайно мягкие.
Физические свойства элементов главной подгруппы III группы
Все элементы группы трехвалентны, но с увеличением атомного номера более характерной становится валентность 1 (Тl преимущественно одновалентен).
В ряду В-Аl-Gа-In-Тl уменьшается кислотность и увеличивается основность гидроксидов R(ОН) 3 . Н 3 ВО 3 - кислота, Аl(ОН) 3 и Gа(ОН) 3 - амфотерные основания, In(ОН) 3 и Тl(ОН) 3 - типичные основания. ТlOН - сильное основание.
Рассмотрим свойства только двух элементов: подробно - алюминия, как типичного представителя р-металлов, чрезвычайно широко применяемого на практике, и схематично - бора, как представителя «полуметаллов» и проявляющего аномальные свойства по сравнению со всеми другими элементами подгруппы.
Алюминий - самый распространенный металл на Земле (3-е место среди всех элементов; 8% состава земной коры). В виде свободного металла в природе не встречается; входит в состав глиноземов (Аl 2 О 3), бокситов (Аl 2 О 3 xН 2 О). Кроме того, алюминий обнаруживается в виде силикатов в таких породах, как глины, слюды и полевые шпаты.
Алюминий имеет единственный стабильный изотоп , бор - два: 19,9% и 80,1%.
Получение;
1. Электролиз расплава AlCl 3:
2AlCl 3 = 2Al + 3Cl 2
2. Основной промышленный способ - электролиз расплава Al 2 O 3 (глинозема) в криолите 3NaF AlF 3:
2Al 2 O 3 = 4AI + 3O 2
3. Вакуумтермический:
AlCl 3 + ЗК = Al + 3KCl
Физические свойства .
Алюминий в свободном виде - серебристо-белый металл, обладающий высокой тепло- и электропроводностью. Алюминий имеет невысокую плотность - примерно втрое меньше, чем у железа или меди, и одновременно - это прочный металл.
Бор существует в нескольких аллотропных модификациях. Аморфный бор представляет собой темно-коричневый порошок. Кристаллический бор - серо-черный, с металлическим блеском. По твердости кристаллический бор занимает второе место (после алмаза) среди всех веществ. При комнатной температуре бор плохо проводит электрический ток; так же, как кремний, он обладает полупроводниковыми свойствами.
Химические свойства .
Поверхность алюминия обычно покрыта прочной пленкой оксида Аl 2 О 3 , которая предохраняет его от взаимодействия с окружающей средой. Если эту пленку удаляют, то металл может энергично реагировать с водой:
2Аl + 6Н 2 О = 2Аl(ОН) 3 + ЗН 2 .
В виде стружек или порошка он ярко горит на воздухе, выделяя большое количество теплоты:
2Аl + 3/2O 2 = Аl 2 О 3 + 1676 кДж.
Это обстоятельство используется для получения ряда металлов из их оксидов методом алюмотермии. Так назвали восстановление порошкообразным алюминием тех металлов, у которых теплоты образования оксидов меньше теплоты образования Аl 2 О 3 , например:
Сr 2 О 3 + 2Аl = 2Сr + Аl 2 О 3 + 539 кДж.
Бор , в отличие от алюминия, химически инертен (особенно кристаллический). Так, с кислородом он реагирует только при очень высоких температурах (> 700°С) с образованием борного ангидрида В 2 О 3:
2В + ЗО 2 = 2В 2 О 3 ,
с водой бор не реагирует ни при каких обстоятельствах. При еще более высокой температуре (> 1200°С) он взаимодействует с азотом, давая нитрид бора (служит для изготовления огнеупорных материалов):
Лишь со фтором бор реагирует при комнатной температуре, реакции же с хлором и бромом протекают только при сильном нагревании (400 и 600 °С соответственно); во всех этих случаях он образует тригалогениды ВНal 3 - дымящие на воздухе летучие жидкости, легко гидролизующиеся водой:
2В + 3Наl 2 = 2ВНаl 3 .
В результате гидролиза образуется ортоборная (борная) кислота H 3 BO 3:
ВНаl 3 + 3Н 2 О = Н 3 ВО 3 + ЗННаl.
В отличие от бора, алюминий уже при комнатной температуре активно реагирует со всеми галогенами, образуя галогениды. При нагревании он взаимодействует с серой (200 °С), азотом (800 °С), фосфором (500 °С) и углеродом (2000 °С):
2Аl + 3S = Аl 2 S 3 (сульфид алюминия),
2Аl + N 2 = 2АlN (нитрид алюминия),
Аl + Р = АlР (фосфид алюминия),
4Аl + 3С = Аl 4 С 3 (карбид алюминия).
Все эти соединения полностью гидролизуются с образованием гидроксида алюминия и, соответственно, сероводорода, аммиака, фосфина и метана.
Алюминий легко растворяется в соляной кислоте любой концентрации:
2Аl + 6НСl = 2АlСl 3 + ЗН 2 .
Концентрированные серная и азотная кислоты на холоде не действуют на алюминий. При нагревании алюминий способен восстанавливать эти кислоты без выделения водорода:
2Аl + 6Н 2 SО 4(конц) = Аl 2 (SО 4) 3 + 3SО 2 + 6Н 2 О,
Аl + 6НNO 3(конц) = Аl(NO 3) 3 + 3NO 2 + 3Н 2 О.
В разбавленной серной кислоте алюминий растворяется с выделением водорода:
2Аl + 3Н 2 SО 4 = Аl 2 (SО 4) 3 + 3Н 2 .
В разбавленной азотной кислоте реакция идет с выделением оксида азота (II):
Аl + 4HNО 3 = Аl(NО 3) 3 + NO + 2Н 2 О.
Алюминий растворяется в растворах щелочей и карбонатов щелочных металлов с образованием тетрагидроксоалюминатов:
2Аl + 2NаОН + 6Н 2 О = 2Na[Аl(ОН) 4 ] + 3Н 2 .
Кислоты, не являющиеся окислителями, с бором не реагируют и только концентрированная HNO 3 окисляет его до борной кислоты:
В + HNO 3(конц) + Н 2 О = Н 3 ВO 3 + NO
Соединения со степенью окисления +3. Важнейшими соединениями бора являются гидриды, галогениды, оксид, борные кислоты и их соли.
Оксид бора - B 2 O 3 - бесцветная хрупкая стеклообразная масса, кислотный оксид, энергично присоединяет воду с образованием ортоборной кислоты:
B 2 O 3 + 3H 2 O = 2H 3 BO 3
H 3 BO 3 - очень слабая одноосновная кислота, причем ее кислотные свойства проявляются не за счет отщепления катиона водорода, а за счет связывания гидроксид-аниона:
H 3 BO 3 + H 2 O H + + - ; рК а = 9,0
При нагревании борная кислота ступенчато теряет воду, образуя вначале метаборную кислоту, а затем оксид бора:
H 3 BO 3 ¾® HBO 2 ¾® B 2 O 3
При взаимодействии со щелочами образует тетрабораты - соли гипотетической тетраборной кислоты:
4H 3 BO 3 + 2NaOH = Na 2 B 4 O 7 + 7H 2 O
Большинство солей – боратов – в воде нерастворимы, исключение составляют бораты s-элементов. Более других используется тетраборат натрия Na 2 B 4 O 7 . В большинстве своем бораты полимерны, выделяются из растворов в виде кристаллогидратов. Полимерных борных кислот из раствора выделить не удается, в связи с тем, что они легко гидратируются. Поэтому при действии кислот на полибораты обычно выделяется борная кислота (эта реакция используется для получения кислоты):
Na 2 B 4 O 7 + H 2 SO 4 + 5H 2 O = 4H 3 BO 3 + Na 2 SO 4
Безводные метабораты получают сплавлением оксида бора или борной кислоты с оксидами металлов:
CaO + B 2 O 3 = Ca(BO 2) 2
Важнейшими соединениями алюминия является алюминий оксид и алюминий гидроксид.
Алюминий оксид Al2O3 - белая тугоплавкая кристаллической вещество, нерастворимое в воде. В лабораторных условиях алюминий оксид добывают сжигание алюминия или термическими разложением алюминий гидроксида:
4Al + 3O2 → 2Al2O3
2Al (OH) 3→ Al2O3 + 3H2O.
По химическим свойствам алюминий оксид являются амфотерными. Он реагирует с кислотами, проявляя свойства основных оксидов:
Al2O3 + 6HCl = 2AlCl3 + 3H2O.
Реагируйте со щелочами, он проявляет свойства кислотных оксидов. В растворах щелочей образуются комплексные соединения:
Al2O3 + 2KOH + 3H2O = 2K .
При сплавления образуются соли метаалюминиевой кислоты, например, метаалюминат калия:
Al2O3 + 2KOH→2KAlO2 + H2O.
Естественную кристаллическую модификацию алюминий оксида (корунд) применяются в РАЗЛИчНЫХ областях науки и производства. Рубины, например, является материалом для изготовления рабочих камней точных механизмов. Кристаллы корунда - рабочие тела лазеров. Рубины и сапфиры используют для отделки ювелирных изделий. Алюминий оксид является главной составляющей наждака - абразивного материала. Тугоплавкость и коррозионная стойкость алюминий оксида предопределяет его применение для изготовления термостойких химической посуды, кирпича для кладки стекловаренных печей.
Алюминий гидроксид Al (OH) 3 - это нерастворимые в воде кристаллической вещество белого цвета. В лаборатории алюминий гидроксид добывают из растворимых солей алюминия при их взаимодействии с растворами щелочей, например:
AlCl3 + 3КOH = Al (OH) 3 ↓+ 3КCl.
Полученный алюминий гидроксид имеет вид студенистого осадка.
Алюминий гидроксид проявляет амфотерные свойства и растворяется как в кислотах, так и в щелочах:
Al (OH) 3 + 3HCl →AlCl3 + 3H2O
Al (OH) 3 + NaOH → Na .
При сплавления алюминий гидроксида с натрий гидроксидом образуется натрий метаалюминат:
Al (OH) 3 + NaOH→ NaAlO2 + 2H2O.
Способность алюминий гидроксида реагировать с кислотами используют в терапии. Он входит в состав лекарственных препаратов, Которые используются для снижения кислотности и уменьшение изжоге.
Реакция с хлоридом бария.
Борат-ионы при взаимодействии с хлоридом бария в водных растворах образуют белый кристаллический осадок метабората бария Ba(BO 2) 2
Аналитические реакции катиона алюминия Al 3+
1. Реакция с щелочами:
А1 3+ + 3 ОН→А1(ОН) 3 ↓ (белый)
2. Реакция с нитратом кобальта - образование -тенаровой сини.
Тенаровая синь- - смешанный оксид алюминия и кобальта синего цвета.
2 A1 2 (SO 4) 3 + 2 Co(NO 3) 2 -tT-> 2 Со(А1О 2) 2 + 4 NO 2 + 6 SO 3 + O 2 .
Бор относится к примесным микроэлементам, его массовая доля в организме человека составляет 10-5 %. Бор концентрируется главным образом в легких (0,34 мг), щитовидной железе (0,30 мг), селезенке (0,26 мг), печени, мозге (0,22 мг), почках, сердечной мышце (0,21 мг). Биологическое действие бора еще недостаточно изучено. Известно, что бор входит в состав зубов и костей, очевидно, в виде труднорастворимых солей борной кислоты с катионами металлов.
Третья группа периодической системы охватывает очень большое число химических элементов, так как в состав ее, кроме элементов главной и побочной подгрупп, входят элементы с порядковыми номерами 58-71 (лантаноиды) и с порядковыми номерами 90-103 (актиноиды). Мы рассмотрим лантаноиды и актиноиды вместе с элементами побочной подгруппы.
ГЛАВНАЯ ПОДГРУППА ТРЕТЬЕЙ ГРУППЫ
Элементы главной подгруппы третьей группы - бор, алюминий, галлий, индий и таллий-характеризуются наличием трех электронов в наружном электронном слое атома.
Второй снаружи электронный слой атома бора содержит два электрона, атома алюминия - восемь, галлия, индия и таллия - по восемнадцать электронов. Важнейшие свойства этих элементов приведены в табл. 35.
Таблица 35. Некоторые свойства бора, алюминия и его аналогов
Металлические свойства рассматриваемых элементов выражены слабее, чем у соответствующих элементов главных подгрупп второй и особенно первой группы, а у бора преобладают неметаллические свойства. В соединениях они проявляют степень окисленности . Однако с возрастанием атомной массы появляются и более низкие степени окисленности. Для последнего элемента подгруппы - таллия - наиболее устойчивы соединения, в которых его степень окисленности равна .
С увеличением порядкового номера металлические свойства рассматриваемых элементов, как и в других главных подгруппах, заметно усиливаются. Так, оксид бора имеет кислотный характер, оксиды алюминия, галлия и индия - амфотерны, а оксид таллия (III) имеет основной характер.
р-элементы III группы
К р-элементам III группы относятся бор, алюминий, галлий, индий, таллий. Общая электронная формула ns 2 np 1 . Возможные степени окисления:
Металлические свойства в группе усиливаются: бор – неметалл, таллий – типичный металл. На свойствах Ga и его аналогов сказывается d-сжатие, а на свойствах таллия, кроме этого, f-сжатие. Все элементы являются редкими, за исключением алюминия (III место по распространенности на Земле после О и Si).
Нахождение в природе
|
Год от-крытия |
Первооткрыватель |
Минеральное сырьё |
Нахождение в живой природе |
|
|
Гей-Люссак (Фра-нция); Дэви (Анг-лия) от араб. buraq- блестеть |
бура Na 2 B 4 O 7 10H 2 O; сассолин Н 3 ВО 3 – содержится в вулкани-ческих парах, горячих источ-никах, BN – нитрид бора. |
Микроэлемент питания растений, в избытке токси-чен. Токсич. доза для че-ловека 4 г. |
||
|
Эрстед (Дания) от лат. alumen –квасцы |
боксит Al 2 O 3 nH 2 O; алюмо-силикаты, криолит Na 3 , корунд – красный рубин (Cr 3+); синий сапфир (Ti 3+ , Fe 3+); нефелин Na 2 OAl 2 O 3 2SiO 2 ; алунит K 2 SO 4 Al 2 (SO 4) 3 2Al 2 O 3 6H 2 O (всего 250 минералов) |
В организме человека накапливается с ежеднев-ным приёмом пищи, играет роль в развитии болезни Альцхаймера. Токсич. доза 5 г. Сод-ние в орг-зме ч-ка 70 кг – 61 мг. |
||
|
Лекок де Буабод-ран (Франция) от лат. Gallia – Франция |
Присутствует в количествах более 1% в минералах других элементов. Извлекается как по-бочный продукт в пр-ве Zn и Cu |
Стимулятор биохимических процессов, малотоксичен. |
||
|
Райх, Рихтер (Гер-мания), назван по линии индиго в его спектре |
Встречается в виде примеси (до 1%) в сульфидной цинковой ру-де и галените PbS, получают как побоч. про-кт при пр-ве Zn и Pb |
Токсическая доза 30 мг, летальная доза 200 мг. |
||
|
Крукс (Англия) Лэми (Франция) от греч. thallos – зелёный |
В природе встречается редко: в виде включений в поташе, поллуците. Получают как побочный продукт пр-ва Zn и Pb |
Летальная доза 600 мг |
Простые вещества
Некоторые физические константы приведены в таблице:
Выводы: алюминий относится к лёгким металлам, галлий, индий, таллий – к тяжёлым. Все металлы IIIA группы – легкоплавкие, особенно галлий – плавится в руке- (из всех известных веществ он имеет самый большой температурный интервал существования жидкого состояния – в жидком состоянии он очень склонен к переохлаждению и долго не застывает). Твёрдость бора близка к твёрдости алмаза. Галлий, индий, таллий режутся ножом.
По свойствам бор-неметалл сильно отличается от остальных р-элементов третьей группы. Бор имеет две аллотропные модификации, в них атомы бора объединены в группировки В 12:
Аморфный – порошок бурого цвета.
кристаллический - кристаллы чёрно-красного цвета с малой энтропией, тугоплавки, диамагнитны, обладают полупроводниковыми свойствами.
Химически бор инертен, причём кристаллический бор инертнее аморфного. Проявляет диагональное сходство с кремнием: для них наиболее характерны производные с положительными степенями окисления, низшие гидриды малоустойчивы и газообразны.
Взаимодействие бора с простыми веществами можно представить схемой:
+ F 2 (20-25 o C) BF 3
+ Cl 2 , Br 2 , I 2 (400-900 o C) BCl 3 , BBr 3 , BI 3
+ S (610 o C) B 2 S 3
В + O 2 (700 o C, воздух) 4B + 3O 2 = 2B 2 O 3 ; Н = -2508 кДж
+ N 2 , (900 o C) BN
+ P (1200 o C) BP
+ C (2000 o C) B 4 C
Спекание бора со многими металлами приводит к образованию боридов металлов. Бориды s-элементов MgB 2 химически активны. Большинство боридов d- и f-элементов очень тверды, жаростойки (2000-3000 о С) и химически устойчивы. (Cr 4 B, Cr 3 B, CrB, CrB 2). Например, борид циркония ZrB 2 плавится при температуре 3040 о С. Их применяют для изготовления деталей реактивных двигателей и пр., а также, как катализаторы.
Водород не взаимодействует с бором даже при высокой температуре. Соединения бора с водородом – бороводороды – бораны- получают косвенным путём.
При сильном нагревании восстановительная активность бора проявляется в отношении устойчивых оксидов:
2B + 3HOH = B 2 O 3 + 3H 2
3SiO 2 + 4B = 3Si + 2B 2 O 3
На бор действуют лишь горячие концентрированные HNO 3 и H 2 SO 4 , переводя его в Н 3 ВО 3:
B + 3HNO 3 = H 3 BO 3 + 3NO 2
2B + 3H 2 SO 4 = 2H 3 BO 3 + 3SO 2
Щёлочи при отсутствии окислителей на кристаллический бор не действуют. Аморфный бор растворяется в концентрированных растворах щелочей с образованием метаборатов:
2В + 2КОН + 2Н 2 О = 2КВО 2 + 3Н 2
Все p-элементы III группы, кроме бора, металлы. Они имеют серебристо-белый цвет. Алюминий, галлий, индий покрыты оксидной плёнкой. В ряду напряжений расположены до водорода, алюминий – между магнием и цинком, остальные металлы вблизи железа.
Алюминий – является самым первым и самым лёгким р-металлом, обладает высокой электро- и теплопроводностью, исключительно пластичен. Наблюдается диагональное сходство с бериллием и горизонтальное с кремнием (особенно в алюмосиликатах).
Он химически очень активен, но в обычных условиях покрыт очень прочной тончайшей оксидной плёнкой ~ 10 нм, за счёт чего обладает коррозионной устойчивостью. Почти все реакции с участием алюминия идут с латентным (скрытым) периодом, необходимым для разрушения оксидной плёнки или диффузии реагента через неё.
Лишь в мелкораздробленном состоянии при высокой температуре горит в кислороде и взаимодействует с серой, при сильном нагревании 800 о С реагирует с азотом и при 2000 о С - углеродом. С хлором и бромом – при обычной температуре, с йодом при нагревании или в присутствии воды – катализатора.
20 o C: + F 2 (Cl 2 , Br 2) = AlF 3 , AlCl 3 , AlBr 3
20 o C: + Cat (H 2 O) + I 2 = AlI 3
Al поджигание (небольшой нагрев): + О 2 (S) = Al 2 O 3 , Al 2 S 3
800 o C: + N 2 = AlN
высокая температура: + Ме x О y = nAl 2 O 3 + xMe (алюминотермия)
2000 o C: + C = Al 4 C 3
Аl активно восстанавливает многие металлы из оксидов. Алюминотермия или алюмотермия – способ получения Mn, Cr, V, W.
Cr 2 O 3 + 2Al = Al 2 O 3 + 2Cr
При нагревании:
2Al + 2NH 3 2AlN + 3H 2
Алюминий амфотерен и растворяется в растворах кислот и щелочей.
2Al + 3H 2 SO 4 разб = Al 2 (SO 4) 3 + 3H 2
2Al + 2NaOH + 8HOH = 2Na + 3H 2
Аl заметно растворяется в растворах солей, имеющих вследствие их гидролиза кислую или щелочную реакцию, например, в растворе Na 2 CO 3 .
Если механическим путём или амальгамированием (формированием поверхностной пленки из твердого раствора алюминия с ртутью) удалить оксидную плёнку, то алюминий энергично взаимодействует с водой:
2Al + 6H 2 O = 2Al(OH) 3 + 3H 2
Алюминий пассивируется (вследствие образования защитной плёнки) в очень разбавленной и концентрированной азотной кислоте, а также в концентрированной серной кислоте.
Соединения со степенью окисления +1
Для таллия известны многочисленные соединения, производные же галлия и индия неустойчивы и являются сильными восстановителями.
Ион Tl + имеет радиус (0,144 нм) близкий к радиусам K, Rb и Ag. Поэтому химия таллия напоминает химию щелочных металлов и Ag. Соединения Tl + - преимущественно ионные, большинство соединений растворяется в воде. По химическим свойствам оксид и гидроксид проявляют основные свойства:
Tl 2 O + HOH = 2TlOH
Гидроксид таллия – сильное основание, но при нагревании до 100 о С отщепляет воду:
2TlOH = Tl 2 O + HOH
Для Tl + не характерно комплексообразование, он не образует даже кристаллогидратов.
Соединения со степенью окисления +3
В . Степень окисления +3 проявляется у бора в соединениях с более электроотрицательными элементами, чем он сам, т.е. в оксиде, галогенидах, сульфиде, нитриде, гидридах и т.д.
Оксид бора имеет кислотный характер,
B 2 O 3 + 2KOH = 2KBO 2 + H 2 O
Его получают обезвоживанием борной кислоты. Оксид бора энергично взаимодействует с водой с образованием борной кислоты:
B 2 O 3 + 3H 2 O = 2H 3 BO 3
Применение: в неорганическом синтезе – необходимая часть эмалей и глазурей; прибавление B 2 O 3 в шихту для приготовления стекла увеличивает его твёрдость, термостойкость и химическую стойкость – из такого стекла изготавливается высококачественная химическая посуда.
Борная или ортоборная кислота Н 3 ВО 3 представляет собой белые кристаллы, блестящие чешуйки которых растворяются в горячей воде. Это очень слабая кислота - при 20 о С:
К 1 = 610 -10 ; К 2 =210 -13 ; К 3 = 210 -14 .
Водные растворы солей борной кислоты гидролизуются, обладают сильной щелочной реакцией. При нагревании борная кислота ступенчато теряет воду, переходя в метаборную кислоту и тетраборную кислоту и затем в борный ангидрид:
H 3 BO 3 HBO 2 Н 2 В 4 О 7 B 2 O 3
Со спиртами в присутствии серной кислоты может давать эфиры:
B(OH) 3 + 3CH 3 OH = B(OCH 3) 3 + 3HOH
Способ получения борной кислоты:
Na 2 B 4 O 7 + H 2 SO 4 + 5H 2 O = Na 2 SO 4 + 4H 3 BO 3
Применение борной кислоты: для приготовления эмалей и глазурей, в производстве спец. видов стекла, в бумажном и кожевенном производстве, в качестве дезинфецирующего средства.
Вывод: много общего имеет химия кислородных соединений бора и кремния: кислотная природа оксидов и гидроксидов, стеклообразование оксидов, способность образовывать многочисленные полимерные структуры.
Галогениды бора ВГ 3 известны для всех галогенов, их можно получать из простых веществ при нагревании. Другие способы получения галогенидов бора: при нагревании:
B 2 O 3 + 3C + 3Cl 2 = 3BCl 3 + 3CO
B 2 O 3 + 3CaF 2 + 3H 2 SO 4 = 2BF 3 + 3CaSO 4 + 3H 2 O
Их молекулы имеют форму плоского треугольника, причем орбитали бора участвуют в sp 2 – гибридизации. BF 3 - газ; BCl 3 , BBr 3 – жидкости; BI 3 – твёрдое вещество. В связи с увеличением длины связи и уменьшением её энергии в ряду BF 3 - ВCl 3 - BBr 3 – BI 3 устойчивость соединений уменьшается. Наибольшее применение имеют фторид и хлорид бора. При гидролизе фторида бора образуется комплексная борофтористоводородная кислота:
4BF 3 + 3HOH = H 3 BO 3 + 3H
Способность к донорно-акцепторному взаимодействию за счет свободной орбитали атома бора определяет применение галогенидов бора в качестве катализаторов в органическом синтезе.
Сульфид B 2 S 3 – стеклообразное вещество, водой полностью разлагается в результате гидролиза.
Гидриды бора (бораны) имеют состав B n H n +4 или B n H n +6 , простейшее водородное соединение ВН 3 в обычных условиях не существует, простейшими представителями являются B 2 H 6 , B 4 H 10 - газы; B 5 H 9 , B 6 H 10 - жидкости; B 10 H 14 –твёрдое вещество. Все бораны получают косвенным путём.
2Mg 3 B 2 + 12HOH = B 4 H 10 + H 2 + 6Mg(OH) 2
Бораны химически активны. На воздухе самовоспламеняются и сгорают с выделением очень большого количества тепла. Поэтому их можно использовать в качестве ракетного топлива:
В 2 Н 6 + 3О 3 3Н 2 О + В 2 О 3
Они разлагаются водой, спиртами, щелочами с выделением водорода:
В 2 Н 6 + 6Н 2 О = 2Н 3 ВО 3 + 6Н 2
В среде эфира В 2 Н 6 реагирует с гидридом лития, образуя тетрагидридоборат лития:
B 2 H 6 + 2LiH = 2Li
Большинство боранов имеют отвратительный запах и очень ядовиты!
Нитрид бора BN («белый графит») – белый порошок, его строение аналогично графиту: расслаивается на чешуйки, высокая огнеупорность, химическая инертность. Применяется в качестве изолятора и как твёрдая высокотемпературная смазка. Существует и алмазоподобная модификация BN – боразон или эльбор, в которой атомы бора и азота находятся в sp 3 -гибридизации. Он применяется как сверхтвёрдый материал в буровых работах, при обработке металлов резанием.
Карбид бора В 4 С (Т пл = 2350 о С) обладает высокой твёрдостью (уступает алмазу и боразону) и химической стойкостью, сохраняющимися даже при высоких температурах.
Для 3 p -элементов, являющихся металлами , характерны координационные числа 4 и 6.
Для Al 3+ - бинарные соединения
AlF 3 , AlCl 3 , Al 2 O 3 , Al 2 S 3, AlN, AlH 3
в обычных условиях полимерны. Это твёрдые вещества белого цвета.
Оксиды: в ряду Al 2 O 3 - Ga 2 O 3 -In 2 O 3 -Tl 2 O 3 наблюдается усиление основных свойств, возрастает растворимость в кислотах, уменьшается устойчивость.
Оксид Al 2 O 3 –глинозём – встречается в природе в виде корунда. Прозрачные окрашенные кристаллы корунда: красный - рубин (Cr 3+); синий - сапфир (Ti 3+ , Fe 3+) – драгоценные камни, их также получают искусственно. Кристаллы Al 2 O 3 химически очень стойки, не взаимодействуют с водой. При длительном нагревании:
Al 2 O 3 + 6HCl = 2AlCl 3 + 3H 2 O
Al 2 O 3 + 2NaOH + 7HOH = 2Na
Оксид Al 2 O 3 получают:
из бокситов (содержат Fe 2 O 3 , SiO 2 , CaO и др.) либо выщелачиванием NaOH высококачественных бокситов (выщелачивание – извлечение компонентов из различных видов сырья (руды, концентраты, промышленные отходы и др.) путём обработки их водными растворами других реагентов - щёлочи, вода, кислоты), либо спеканием с содой низкокачественных бокситов:
Al 2 O 3 + Na 2 CO 3 = 2NaAlO 2 + CO 2
2NaAlO 2 + CO 2 + 3H 2 O = 2Al(OH) 3 + Na 2 CO 3
или из нефелинов спеканием с известняком (1200 o C):
Na 2 OAl 2 O 3 2SiO 2 + 2СaCO 3 = 2CaSiO 3 + 2NaAlO 2 + 2CO 2
Образовавшийся алюминат натрия выщелачивают водой, а нерастворившийся силикат кальция применяют для производства цемента.
2Al(OH) 3 = Al 2 O 3 + 3H 2 O
Гидроксид алюминия – полимерное соединение. Его получают по уравнению:
Na + CO 2 = Al(OH) 3 + NaHCO 3
Это типичное амфотерное соединение, свежеполученный продукт растворяется в кислотах и щелочах. У Ga(OH) 3 основная и кислотная функции проявляются примерно в одинаковой степени, у In(OH) 3 основные свойства преобладают над кислотными, у Tl(OH) 3 кислотная функция выражена слабо и почти не проявляется.
Гидрид алюминия - полимерное соединение - получают косвенным путём в эфирном растворе:
AlCl 3 + 3LiH = AlH 3 + 3LiCl
В избытке LiH:
4AlCl 3 + 4LiH = 4Li + 12HCl
Образующийся комплекс (тетрагидридоалюминат лития) – сильный восстановитель, например, бурно реагирует с водой:
Li + 4H 2 O = LiOH + Al(OH) 3 + 4H 2
Хлорид алюминия широко применяется в качестве катализатора в органических синтезах. Он выделяется среди галидов алюминия по своим аномальным свойствам. При его плавлении при 190-192 о С почти вдвое увеличивается объём, а электропроводность уменьшается почти до 0, что связано с переходом ионной структуры в молекулярную. Галиды алюминия димеризуются даже в парообразном состоянии:
2AlCl 3 = Al 2 Cl 6 + 121 кДж
2AlI 3 = Al 2 I 6 +94 кДж
В растворах соли алюминия сильно гидролизуются (сульфат и хлорид -коагулянты).
Al 2 S 3 + 6H 2 O = 2Al(OH) 3 + 3H 2 S
AlN + 3HOH = Al(OH) 3 + NH 3
2Al(CH 3 COO) 3 + 3H 2 O = (t) AlOH(CH 3 COO) 2 + Al(OH) 2 CH 3 COO + 3CH 3 COOH
Совместный гидролиз:
2Al 3+ + 3CO 3 2- + 3HOH = 2Al(OH) 3 + 3CO 2
Для солей кислородсодержащих кислот характерно образование кристаллогидратов с большим числом молекул воды Al(NO 3) 3 9H 2 O. Алюминиевокалиевые квасцы KAl(SO 4) 2 12H 2 O применяются для дубления кож, в красильном деле для протравы х/б тканей.