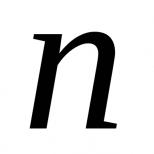Уравнения в ионном виде. Алгоритм написания ионных уравнений. Как превратить молекулярное уравнение в полное ионное уравнение
Тема: Химическая связь. Электролитическая диссоциация
Урок: Составление уравнений реакций ионного обмена
Составим уравнение реакции между гидроксидом железа (III) и азотной кислотой.
Fe(OH) 3 + 3HNO 3 = Fe(NO 3) 3 + 3H 2 O
(Гидроксид железа (III) является нерастворимым снованием, поэтому не подвергается . Вода - малодиссоциируемое вещество, на ионы в растворе практически недиссоциировано.)
Fe(OH) 3 + 3H + + 3NO 3 - = Fe 3+ + 3NO 3 - + 3H 2 O
Зачеркнем одинаковое количество нитрат-анионов слева и справа, запишем сокращенное ионное уравнение:
Fe(OH) 3 + 3H + = Fe 3+ + 3H 2 O
Данная реакция протекает до конца, т.к. образуется малодиссоциируемое вещество - вода.
Составим уравнение реакции между карбонатом натрия и нитратом магния.
Na 2 CO 3 + Mg(NO 3) 2 = 2NaNO 3 + MgCO 3 ↓
Запишем данное уравнение в ионной форме:
(Карбонат магния является нерастворимым в воде веществом, следовательно, на ионы не распадается.)
2Na + + CO 3 2- + Mg 2+ + 2NO 3 - = 2Na + + 2NO 3 - + MgCO 3 ↓
Зачеркнем одинаковое количество нитрат-анионов и катионов натрия слева и справа, запишем сокращенное ионное уравнение:
CO 3 2- + Mg 2+ = MgCO 3 ↓
Данная реакция протекает до конца, т.к. образуется осадок - карбонат магния.
Составим уравнение реакции между карбонатом натрия и азотной кислотой.
Na 2 CO 3 + 2HNO 3 = 2NaNO 3 + CO 2 + H 2 O
(Углекислый газ и вода - продукты разложения образующейся слабой угольной кислоты.)
2Na + + CO 3 2- + 2H + + 2NO 3 - = 2Na + + 2NO 3 - + CO 2 + H 2 O
CO 3 2- + 2H + = CO 2 + H 2 O
Данная реакция протекает до конца, т.к. в результате нее выделяется газ и образуется вода.
Составим два молекулярных уравнения реакций, которым соответствует следующее сокращенное ионное уравнение: Ca 2+ + CO 3 2- = CaCO 3 .
Сокращенное ионное уравнение показывает сущность реакции ионного обмена. В данном случае можно сказать, что для получения карбоната кальция необходимо, чтобы в состав первого вещества входили катионы кальция, а в состав второго - карбонат-анионы. Составим молекулярные уравнения реакций, удовлетворяющих этому условию:
CaCl 2 + K 2 CO 3 = CaCO 3 ↓ + 2KCl
Ca(NO 3) 2 + Na 2 CO 3 = CaCO 3 ↓ + 2NaNO 3
1. Оржековский П.А. Химия: 9-й класс: учеб. для общеобраз. учрежд. / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. - М.: АСТ: Астрель, 2007. (§17)
2. Оржековский П.А. Химия: 9-ый класс: учеб для общеобр. учрежд. / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. - М.: Астрель, 2013. (§9)
3. Рудзитис Г.Е. Химия: неорган. химия. Орган. химия: учеб. для 9 кл. / Г.Е. Рудзитис, Ф.Г. Фельдман. - М.: Просвещение, ОАО «Московские учебники», 2009.
4. Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. - М.: РИА «Новая волна»: Издатель Умеренков, 2008.
5. Энциклопедия для детей. Том 17. Химия / Глав. ред. В.А. Володин, вед. науч. ред. И. Леенсон. - М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов (видеоопыты по теме): ().
2. Электронная версия журнала «Химия и жизнь»: ().
Домашнее задание
1. Отметьте в таблице знаком «плюс» пары веществ, между которыми возможны реакции ионного обмена, идущие до конца. Составьте уравнения реакций в молекулярном, полном и сокращенном ионном виде.
|
Реагирующие вещества |
K 2 CO 3 |
AgNO 3 |
FeCl 3 |
HNO 3 |
|
|
CuCl 2 |
|||||
2. с. 67 №№ 10,13из учебника П.А. Оржековского «Химия: 9-ый класс» / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. - М.: Астрель, 2013.
Инструкция
Рассмотрите пример образования труднорастворимого соединения.
Na2SO4 + BaCl2 = BaSO4 + 2NaCl
Или вариант в ионном виде:
2Na+ +SO42- +Ba2++ 2Cl- = BaSO4 + 2Na+ + 2Cl-
При решении ионных уравнений, необходимо соблюдать следующие правила:
Одинаковые ионы из обеих его частей исключаются;
Следует помнить, что сумма электрических зарядов в левой части уравнения должна быть равна сумме электрических зарядов в правой части уравнения.
Написать ионные уравнения взаимодействия между водными растворами следующих веществ: a) HCl и NaOH; б) AgNO3 и NaCl; в) К2СO3 и H2SO4; г) СН3СOOH и NaOH.
Решение. Запишите уравнения взаимодействия указанных веществ в молекулярном виде:
а) HCl + NaOH = NaCl + H2O
б) AgNO3 + NaCl = AgCl + NaNO3
в) K2CO3 + H2SO4 = K2SO4 + CO2 + H2O
г) СН3СOOH + NaOH = CH3COONa + H2O
Отметьте, что взаимодействие этих веществ возможно, ибо в результате происходит связывание ионов с образованием либо слабых (Н2О), либо труднорастворимого вещества (AgCl), либо газа (СO2).
Исключив одинаковые ионы из левых и правых частей равенства (в случае варианта а) – ионы и , в случае б) – ионы натрия и -ионы, в случае в) – ионы калия и сульфат-ионы), г) – ионы натрия, получите решение этих ионных уравнений:
а) H+ + OH- = H2O
б) Ag+ + Cl- = AgCl
в) CO32- + 2H+ = CO2 + H2O
г) СН3СOOH + OH- = CH3COO- + H2O
Довольно часто в самостоятельных и контрольных работах встречаются задания, предполагающие решение уравнений реакций. Однако без некоторых знаний, навыков и умений даже самые простые химические уравнения не написать.
Инструкция
Прежде всего нужно изучить основные органических и неорганических соединений. На крайний случай можно иметь перед собой подходящую шпаргалку, которая сможет помочь во время выполнения задания. После тренировки все равно в памяти отложатся необходимые знания и умения.
Базовым является материал, охватывающий , а также способы получения каждого соединений. Обычно они представлены в виде общих схем, например: 1. + основание = соль + вода
2. кислотный оксид + основание = соль + вода
3. основный оксид + кислота = соль + вода
4. металл + (разб) кислота = соль + водород
5. растворимая соль + растворимая соль = нерастворимая соль + растворимая соль
6. растворимая соль + = нерастворимое основание + растворимая соль
Имея перед глазами таблицу растворимости солей, и , а также схемы-шпаргалки, можно по ним решать уравнения
реакций. Важно только иметь полный перечень таких схем, а также сведения о формулах и названиях различных классов органических и неорганических соединений.
После того, как удастся само уравнение, необходимо проверить правильность написания химических формул. Кислоты, соли и основания легко проверяются по таблице растворимости, в которой указаны заряды ионов кислотных остатков и металлов. Важно помнить, что любая должна быть в целом электронейтральна, то есть, количество положительных зарядов должно совпадать с количеством отрицательных. Обязательно при этом учитываются индексы, которые перемножаются на соответствующие заряды.
Если и этот этап пройден и имеется уверенность в правильности написания уравнения
химической реакции
, то можно теперь смело расставлять коэффициенты. Химическое уравнение представляет собой условную запись реакции
с помощью химических символов, индексов и коэффициентов. На этом этапе выполнения задания обязательно нужно придерживаться правил: Коэффициент ставится перед химической формулой и относится ко всем элементам, входящим в состав вещества.
Индекс ставится после химического элемента немного внизу, и относится только к стоящему слева от него химическому элементу.
Если группа (например, кислотный остаток или гидроксильная группа) стоит в скобках, то нужно усвоить, что два, рядом стоящих индекса (перед скобкой и после нее) перемножаются.
При подсчете атомов химического элемента коэффициент умножается (не складывается!) на индекс.
Далее подсчитывается количество каждого химического элемента таким образом, чтобы суммарное число элементов, входящих в состав исходных веществ совпадало с числом атомов, входящих в состав соединений, образовавшихся продуктов реакции . Путем анализа и применения, вышеизложенных, правил можно научиться решать уравнения реакций, входящих в состав цепочек веществ.
При нейтрализации любой сильной кислоты любым сильным основанием на каждый моль образующейся воды выделяется около теплоты:
Это говорит о том, что подобные реакции сводятся к одному процессу. Уравнение этого процесса мы получим, если рассмотрим подробнее одну из приведенных реакций, например, первую. Перепишем ее уравнение, записывая сильные электролиты в ионной форме, поскольку они существуют в растворе в виде ионов, а слабые - в молекулярной, поскольку они находятся в растворе преимущественно в виде молекул (вода - очень слабый электролит, см. § 90):
Рассматривая получившееся уравнение, видим, что в ходе реакции ионы и не претерпели изменений. Поэтому перепишем уравнение еще раз, исключив эти ионы из обеих частей уравнения. Получим:
Таким образом, реакции нейтрализации любой сильной кислоты любым сильным основанием сводятся к одному и тому же процессу - к образованию молекул воды из ионов водорода и гидроксид-ионов. Ясно, что тепловые эффекты этих реакций тоже должны быть одинаковы.
Строго говоря, реакция образования воды из ионов обратима, что можно выразить уравнением
Однако, как мы увидим ниже, вода - очень слабый электролит и диссоциирует лишь в ничтожно малой степени. Иначе говоря, равновесие между молекулами воды и ионами сильно смещено в сторону образования молекул. Поэтому практически реакция нейтрализации сильной кислоты сильным основанием протекает до конца.
При смешивании раствора какой-либо соли серебра с соляной кислотой или с раствором любой ее соли всегда образуется характерный белый творожистый осадок хлорида серебра:
![]()
Подобные реакции также сводятся к одному процессу. Для того чтобы получить его ионно-молекулярное уравнение, перепишем, например, уравнение первой реакции, записывая сильные электролиты, как и в предыдущем примере, в ионной форме, а вещество, находящееся в осадке, в молекулярной:
Как видно, ионы и не претерпевают изменений в ходе реакции. Поэтому исключим их и перепишем уравнение еще раз:
Это и есть ионно-молекулярное уравнение рассматриваемого процесса.
Здесь также надо иметь в виду, что осадок хлорида серебра находится в равновесии с ионами и в растворе, так что процесс, выраженный последним уравнением, обратим:
Однако, вследствие малой растворимости хлорида серебра, это равновесие очень сильно смещено вправо. Поэтому можно считать, что реакция образования из ионов практически доходит до конца.
Образование осадка будет наблюдаться всегда, когда в одном растворе окажутся в значительной концентрации ионы и . Поэтому с помощью ионов серебра можно обнаружить присутствие в растворе ионов и, наоборот, с помощью хлорид-ионов - присутствие ионов серебра; ион может служить реактивом на ион , а ион - реактивом на ион .
В дальнейшем мы будем широко пользоваться ионно-молекулярной формой записи уравнений реакций с участием электролитов.
Для составления ионно-молекулярных уравнений надо знать, какие соли растворимы в воде и какие практически нерастворимы. Общая характеристика растворимости в воде важнейших солей приведена в табл. 15.
Таблица 15. Растворимость важнейших солей в воде

Ионно-молекулярные уравнения помогают понять особенности протекания реакций между электролитами. Рассмотрим в качеству примера несколько реакций, протекающих с участием слабых кислот и оснований.
Как уже говорилось, нейтрализация любой сильной кислоты любым сильным основанием сопровождается одним и тем же тепловым эффектом, так как она сводится к одному и тому же процессу - образованию молекул воды из ионов водорода и гидроксид-иона.
Однако при нейтрализации сильной кислоты слабым основанием, слабой кислоты сильным или слабым основанием тепловые эффекты различны. Напишем ионно-молекулярные уравнения подобных реакций.
Нейтрализация слабой кислоты (уксусной) сильным основанием (гидроксидом натрия):
Здесь сильные электролиты - гидроксид натрия и образующаяся соль, а слабые - кислота и вода:
Как видно, не претерпевают изменении в ходе реакции только ионы натрия. Поэтому ионно-молекулярное уравнение имеет вид:
Нейтрализация сильной кислоты (азотной) слабым основанием (гидроксидом аммония):
Здесь в виде ионов мы должны записать кислоту и образующуюся соль, а в виде молекул - гидроксид аммония и воду:
Не претерпевают изменений ионы . Опуская их, получаем ионно-молекулярное уравнение:
Нейтрализация слабой кислоты (уксусной) слабым основанием (гидроксидом аммония):
В этой реакции все вещества, кроме образующейся слабые электролиты. Поэтому ионно-молекулярная форма уравнения имеет вид:
Сравнивая между собой полученные ионно-молекулярные уравнения, видим, что все они различны. Поэтому понятно, что неодинаковы и теплоты рассмотренных реакций.
Как уже указывалось, реакции нейтрализации сильных кислот сильными основаниями, в ходе которых ионы водорода и гидроксид-ионы соединяются в молекулу воды, протекают практически до конца. Реакции же нейтрализации, в которых хотя бы одно из исходных веществ - слабый электролит и при которых молекулы малоднссоциирующих веществ имеются не только в правой, но и в левой части ионно-молекулярного уравнения, протекают не до конца.
Они доходят до состояния равновесия, при котором соль сосуществует с кислотой и основанием, от которых она образована. Поэтому уравнения подобных реакций правильнее записывать как обратимые реакции.
Так как электролиты в растворе находятся в виде ионов, то реакции между растворами солей, оснований и кислот – это реакции между ионами, т.е. ионные реакции. Некоторые из ионов, участвуя в реакции, приводят к образованию новых веществ (малодиссоциирующих веществ, осадков, газов, воды), а другие ионы, присутствуя в растворе, не дают новых веществ, но остаются в растворе. Для того, чтобы показать, взаимодействие каких ионов приводит к образованию новых веществ, составляют молекулярные, полные и краткие ионные уравнения.
В молекулярных уравнениях все вещества представлены в виде молекул. Полные ионные уравнения показывают весь перечень ионов имеющихся в растворе при данной реакции. Краткие ионные уравнения составлены лишь теми ионами, взаимодействие между которыми приводит к образованию новых веществ (малодиссоциирующих веществ, осадков, газов, воды).
При составлении ионных реакций следует помнить, что вещества малодиссоциированные (слабые электролиты), мало – и труднорастворимые (выпадающие в осадок – “Н ”, “М ”, см. приложение‚ таблица 4) и газообразные записываются в виде молекул. Сильные электролиты, диссоциированные практически полностью, – в виде ионов. Знак “↓”, стоящий после формулы вещества, указывает на то, что это вещество удаляется из сферы реакции в виде осадка, а знак “”, указывает на удаление вещества в виде газа.
Порядок составления ионных уравнений по известным молекулярным уравнениям рассмотрим на примере реакции между растворами Na 2 CO 3 и HCl.
1. Уравнение реакции записывается в молекулярной форме:
Na 2 CO 3 + 2HCl → 2NaCl + H 2 CO 3
2. Уравнение переписывается в ионной форме, при этом хорошо диссоциирующие вещества записываются в виде ионов, а вещества малодиссоциирующие (в том числе и вода), газы или труднорастворимые – в виде молекул. Коэффициент, стоящий перед формулой вещества в молекулярном уравнении одинаково относится к каждому из ионов, составляющих вещество, и поэтому он выносится в ионном уравнении перед ионом:
2 Na + + CO 3 2- + 2H + + 2Cl - <=> 2Na + + 2Cl - + CO 2 + H 2 O
3. Из обеих частей равенства исключаются (сокращаются) ионы, встречающиеся в левой и правой частях (подчеркнуты соответствующими черточками):
2 Na + + CO 3 2- + 2H + + 2Cl - <=> 2Na + + 2Cl - + CO 2 + H 2 O
4. Ионное уравнение записывается в его окончательном виде (краткое ионоое уравнение):
2H + + CO 3 2- <=> CO 2 + H 2 O
Если в ходе реакции образуются и/или малодиссоциированные, и/или труднорастворимые, и/или газообразные вещества, и/или вода, а в исходных веществах такие соединения отсутствуют‚ то реакция будет практически необратимой (→), и для неё можно составить молекулярное, полное и краткое ионное уравнение. Если такие вещества есть и в реагентах‚ и в продуктах, то реакция будет обратимой (<=>):
Молекулярное уравнение : СаСО 3 + 2HCl <=> CaCl 2 + H 2 O + CO 2
Полное ионное уравнение : СаСО 3 + 2H + + 2Cl – <=> Ca 2+ + 2Cl – + H 2 O + CO 2