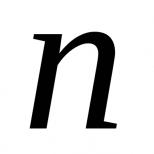Массовая доля растворенного вещества отношение. Как найти массовую долю вещества по формуле
1. Заполните пропуски.
а) Раствор = растворенное вещество + растворитель ;
б) m (раствора) = m (растворенного вещества) + m (растворителя) .
2. Составьте опредлеление, используя следующие слова:
массовая доля, вещества, массы, раствора, к массе, отношение, в растворе, вещества, растворенного.
Ответ: массовая доля вещества в растворе - это отношение массы растворенного вещества к массе раствора.
3. Составьте фомулы, используя обозначения велчин.
| m | m раствора | V |
| p=m/V | w=m(вещества) / m(раствора) | m = w*m(раствора) |
4. Какова массовая доля растворенног вещества, если известно, что в 80 г раствора содержится 20 г соли?
5. Определите массы соли и воды, которые потребуются для приготовления 300 г раствора с массовой долей соли 20%.

6. Вычислите массу воды, необходимую для приготовления 60 г 10%-го растора соли.

7. В аптеке продается порошок "Регидрон", который используют при обезвоживании организма. Один пакет порошка содержит 3б5 г хлорида натрияб 2б5 г хлорида калияб 2ю9 г цитрата натрия и 10 г глюкозыю Содержимле пакета растворяют в 1 л воды. Определите массовые доли всех компонентов порошка "Регидрон" в полученном растворе.

8. К 500 г 20%-го раствора глюкозы добавили 300 г воды. Рассчитайте массовую долю глюкозы в новом растворе.

9. К 400г 5%-го раствора поваренной соли добавили 50 г соли. Рассчитайте массовую долю хлорида натрия в новом растворе.

10. Слили два раствора соли: 100 г 20%-го и 450г 10%-го. Рассчитайте массовую долю соли в новом растворе.
Задача 3.1. Определите массу воды в 250 г 10%-ного раствора хлорида натрия.
Решение.
Из w = m в-ва / m р-ра
находим массу хлорида натрия:
m в-ва = w m р-ра = 0,1 250 г = 25 г NaCl
Поскольку m р-ра = m в-ва + m р-ля
, то получаем:
m(Н 2 0) = m р-ра — m в-ва = 250 г — 25 г = 225 г Н 2 0
.
Задача 3.2. Определите массу хлороводорода в 400 мл раствора соляной кислоты с массовой долей 0,262 и плотностью 1,13 г/мл.
Решение.
Поскольку w = m в-ва / (V ρ)
, то получаем:
m в-ва = w V ρ = 0,262 400 мл 1,13 г/мл = 118 г
Задача 3.3. К 200 г 14%-ного раствора соли добавили 80 г воды. Определите массовую долю соли в полученном растворе.
Решение.
Находим массу соли в исходном растворе:
m соли = w m р-ра = 0,14 200 г = 28 г.
Эта же масса соли осталась и в новом растворе. Находим массу нового раствора:
m р-ра = 200 г + 80 г = 280 г.
Находим массовую долю соли в полученном растворе:
w = m соли / m р-ра = 28 г / 280 г = 0,100.
Задача 3.4. Какой объем 78%-ного раствора серной кислоты с плотностью 1,70 г/мл надо взять для приготовления 500 мл 12%-ного раствора серной кислоты с плотностью 1,08 г/мл?
Решение.
Для первого раствора имеем:
w 1 = 0,78
и ρ 1 = 1,70 г/мл
.
Для второго раствора имеем:
V 2 = 500 мл, w 2 = 0,12
и ρ 2 = 1,08 г/мл
.
Поскольку второй раствор готовим из первого добавлением воды, то массы вещества в обоих растворах одинаковы. Находим массу вещества во втором растворе. Из w 2 = m 2 / (V 2 ρ 2)
имеем:
m 2 = w 2 V 2 ρ 2 = 0,12 500 мл 1,08 г/мл = 64,8 г.
m 2 = 64,8 г
. Находим
объем первого раствора. Из w 1 = m 1 / (V 1 ρ 1)
имеем:
V 1 = m 1 / (w 1 ρ 1) = 64,8 г / (0,78 1,70 г/мл) = 48,9 мл.
Задача 3.5. Какой объем 4,65%-ного раствора гидроксида натрия с плотностью 1,05 г/мл можно приготовить из 50 мл 30%-ного раствора гидроксида натрия с плотностью 1,33 г/мл?
Решение.
Для первого раствора имеем:
w 1 = 0,0465
и ρ 1 = 1,05 г/мл
.
Для второго раствора имеем:
V 2 = 50 мл
, w 2 = 0,30
и ρ 2 = 1,33 г/мл
.
Поскольку первый раствор готовим из второго добавлением воды, то массы вещества в обоих растворах одинаковы. Находим массу вещества во втором растворе. Из w 2 = m 2 / (V 2 ρ 2)
имеем:
m 2 = w 2 V 2 ρ 2 = 0,30 50 мл 1,33 г/мл = 19,95 г.
Масса вещества в первом растворе также равна m 2 = 19,95 г
.
Находим объем первого раствора. Из w 1 = m 1 / (V 1 ρ 1)
имеем:
V 1 = m 1 / (w 1 ρ 1) = 19,95 г / (0,0465 1,05 г/мл) = 409 мл
.
Коэффициент растворимости (растворимость) - максимальная масса вещества, растворимая в 100 г воды при данной температуре. Насыщенный раствор - это раствор вещества, который находится в равновесии с имеющимся осадком этого вещества.
Задача 3.6. Коэффициент растворимости хлората калия при 25 °С равен 8,6 г. Определите массовую долю этой соли в насыщенном растворе при 25 °С.
Решение.
В 100 г воды растворилось 8,6 г соли.
Масса раствора равна:
m р-ра = m воды + m соли = 100 г + 8,6 г = 108,6 г
,
а массовая доля соли в растворе равна:
w = m соли / m р-ра = 8,6 г / 108,6 г = 0,0792
.
Задача 3.7. Массовая доля соли в насыщенном при 20 °С растворе хлорида калия равна 0,256. Определите растворимость этой соли в 100 г воды.
Решение.
Пусть растворимость соли равна х
г в 100 г воды.
Тогда масса раствора равна:
m р-ра = m воды + m соли = (х + 100) г
,
а массовая доля равна:
w = m соли / m р-ра = х / (100 + х) = 0,256
.
Отсюда
х = 25,6 + 0,256х; 0,744х = 25,6; х = 34,4 г
на 100 г воды.
Молярная концентрация с
- отношение количества растворенного вещества v (моль)
к объему раствора V (в литрах)
, с = v(моль) / V(л)
, с = m в-ва / (М V(л))
.
Молярная концентрация показывает число моль вещества в 1 л раствора: если раствор децимолярный (с = 0,1 М = 0,1 моль/л
) значит, что в 1 л раствора содержится 0,1 моль вещества.
Задача 3.8. Определите массу КОН, необходимую для приготовления 4 л 2 М раствора.
Решение.
Для растворов с молярной концентрацией имеем:
с = m / (М V)
,
где с
- молярная концентрация,
m
- масса вещества,
М
- молярная масса вещества,
V
- объем раствора в литрах.
Отсюда
m = с М V(л) = 2 моль/л 56 г/моль 4 л = 448 г КОН
.
Задача 3.9. Сколько мл 98%-ного раствора Н 2 SO 4 (ρ = 1,84 г/мл) необходимо взять для приготовления 1500 мл 0,25 М раствора?
Решение. Задача на разбавление раствора. Для концентрированного раствора имеем:
w 1 = m 1 / (V 1 (мл) ρ 1)
.
Необходимо найти объем этого раствора V 1 (мл) = m 1 / (w 1 ρ 1)
.
Поскольку разбавленный раствор готовится из концентрированного смешиванием последнего с водой, то масса вещества в этих двух растворах будет одинакова.
Для разбавленного раствора имеем:
с 2 = m 2 / (М V 2 (л))
и m 2 = с 2 М V 2 (л)
.
Найденное значение массы подставляем в выражение для объема концентрированного раствора и проводим необходимые вычисления:
V 1 (мл) = m / (w 1 ρ 1) = (с 2 М V 2) / (w 1 ρ 1) = (0,25 моль/л 98 г/моль 1,5 л) / (0,98 1,84 г/мл) = 20,4 мл
.
Инструкция
Массовая доля – это отношение массы растворенного вещества к массе раствора
. Причем она может измеряться или , тогда для этого полученный результат нужно умножить на 100% или в массовых долях (в этом случае единиц не имеет).
Любой раствор состоит из (вода – наиболее распространенный растворитель) и растворенного вещества. Например, в любом растворе соли растворителем будет вода, а в качестве растворенного вещества будет выступать сама соль.
Для расчетов необходимо знать хотя бы два параметра – массу воды и массу соли. Это даст возможность рассчитать массовую долю
вещества , которая w (омега).
Пример 1. Масса раствора
гидроксида (KOH) 150 г, масса растворенного вещества (KOH) 20 г. Найдите массовую долю
(KOH) в полученном растворе.
m (KOH) = 20 г
m (KOH) = 100 г
w (KOH) - ?Существует , по которой можно определить массовую долю
вещества.
w (KOH) = m (KOH) / m (раствора
(KOH) х 100%Теперь рассчитайте массовую долю
растворенного вещества гидроксида калия (KOH):
w (KOH) = 20 г / 120 г х 100% = 16,6 %
Пример 2. Масса воды 100 г, масса соли 20 г. Найдите массовую долю
хлорида в растворе.
m (NaCl) = 20 г
m (воды) = 100 г
w (NaCl) - ?Имеется формула, по которой можно определить массовую долю
вещества.
w (NaCl) = m (NaCl) / m (раствора
NaCl) х 100%Прежде чем воспользоваться данной формулой, найдите массу раствора
, которая состоит из массы растворенного вещества и массы воды. Следовательно: m (раствора
NaCl) = m (растворенного вещества NaCl) + m (воды)Подставьте конкретные значения
m (раствора
NaCl) = 100 г + 20 г = 120 гТеперь рассчитайте массовую долю
растворенного вещества:
w (NaCl) = 20 г / 120 г х 100% = 16,7 %
Полезный совет
При расчете не путайте такие понятия, как масса растворенного вещества и массовая доля растворенного вещества
Массовая доля вещества показывает его содержание в более сложной структуре, например, в сплаве или смеси. Если известна общая масса смеси или сплава, то зная массовые доли составляющих веществ можно найти их массы. Найти массовую долю вещества, можно зная его массу и массу всей смеси. Эта величина, может выражаться в дольных величинах или процентах.
Вам понадобится
- весы;
- периодическая таблица химических элементов;
- калькулятор.
Инструкция
Определите массовую долю вещества, которое находится в смеси через массы смеси и самого вещества. Для этого с помощью весов определите массы , составляющих смесь или . Затем сложите их. Полученную массу примите за 100%. Чтобы найти массовую долю вещества в смеси, поделите его массу m на массу смеси M, а результат умножьте на 100% (ω%=(m/M)∙100%). Например, в 140 г воды растворяют 20 г поваренной соли. Чтобы найти массовую долю соли, сложите массы этих двух веществ М=140+20=160 г. Затем найдите массовую долю вещества ω%=(20/160)∙100%=12,5%.
Чтобы пользоваться предварительным просмотром презентаций создайте себе аккаунт (учетную запись) Google и войдите в него: https://accounts.google.com
Подписи к слайдам:
МБОУ «Хову-Аксынская средняя общеобразовательная школа» РАСТВОРЫ. Вычисление массовой доли растворенного вещества в растворе Урок для 8-го класса Учитель: Хуурак А.Х.
Если ты, придя с мороза, Наливаешь крепкий чай, Хорошенько сахарозу В чашке ложкой размешай.
Задача Бабушка внукам на завтрак приготовила чай, один попросил положить в стакан две чайные ложки сахара, а второй – два кусочка сахара - рафинада. Определите, не пробуя на вкус, в каком стакане чай слаще?
Вопросы Что Вы понимаете под словосочетанием «Сладкий чай» с точки зрения химии? Почему Вы не можете сразу ответить на вопрос задачи? Каких знаний или умений Вам не хватает?
Тема: Растворы. Вычисления массовой доли растворенного вещества в растворе.
Цель: Формирование знаний о растворах, массовой доли растворенного вещества
План урока: Вспомнить, что мы уже знаем по этой теме? Узнать, как найти содержание растворенного вещества в растворе? Узнать количественные данные для решения задачи? Решить предложенную задачу. Применить полученные знания при решении других задач.
О чём идёт речь в задаче, поставленной в начале урока? Что же такое чай с сахаром с точки зрения химии? Из чего состоит любой раствор? Что в нём является растворителем, а что растворенным веществом?
Растворы – это однородные системы, состоящие из молекул растворителя и частиц растворенного вещества, между которыми происходят физические и химические взаимодействия
Вода что добавили + растительное масло + речной песок + поваренная соль (NaCl) + оксид калия (K 2 O) Растворение нет нет да да Химическая реакция нет нет нет да K 2 O + Н 2 О 2КОН Что образовалось неоднородная система (эмульсия) неоднородная система (суспензия) однородная система (раствор) однородная система (раствор)
Взвеси, в которых мелкие капельки какой-либо жидкости равномерно распределены между молекулами воды, называют эмульсиями. Взвеси, в которых мелкие частицы твердого вещества равномерно распределены между молекулами воды, называют суспензиями.
Растворимость веществ в воде Вещества хорошо растворимые (в 100г H 2 O больше 1г вещества) нерастворимые (в 100г H 2 O меньше 0,01г вещества) малорастворимые (в 100г H 2 O меньше 1г вещества) РАСТВОРИМОСТЬ НЕКОТОРЫХ СОЛЕЙ В 100 г ВОДЫ ПРИ 20 °С Хорошо растворимые Сульфат меди Нитрат калия Иодид натрия CuS0 4 KN0 3 Nal 22,2 31,6 179,10 Практически нерастворимые Бромид серебра Хлорид серебра Иодид серебра AgBr AgCl Agl 0,0037 0,00009 0,000003 Малорастворимые Сульфат серебра Сульфат кальция Иодид свинца Ag 2 S0 4 CaS0 4 Pbl 2 0,79 0,20 0,07 Карбонат кальция CaCO 3 Гидроксид кальция Ca (OH) 2 Хлорид кальция CaCl 2
Способность вещества образовывать с другими веществами (растворителями) однородные системы – растворы Зависит: От природы растворяемого вещества От температуры
Растворы насыщенные ненасыщенные это растворы, в которых данное вещество при данной температуре больше растворяться не может это растворы, в которых данное вещество при данной температуре еще может растворяться Коэффициент растворимости – это масса вещества (г), способная раствориться в одном литре растворителя (л) Например, растворимость NANO 3 равна 80,5 г/л при 10 0 С. Это означает, что при данной температуре в одном литре воды может раствориться 80,5 г. нитрата натрия.
Узнайте как найти содержание растворенного вещества в растворе, количественные данные для решения задачи. «В каком стакане чай слаще?»
продолжите предложения Раствор состоит из… Растворителем может быть… Для того, чтобы приготовить раствор заданной концентрации необходимо знать…
РАСТВОРЫ Разбавленные Концентрированные Если в определенном объеме раствора содержится мало растворенного вещества Если в определенном объеме раствора содержится много растворенного вещества
Как выражают содержание вещества в растворе? Содержание вещества в растворе часто выражают в массовых долях.
Что такое массовая доля растворенного вещества? Отношение массы растворенного вещества к массе раствора называют массовой долей растворенного вещества (w - омега): w р.в.- массовая доля растворенного вещества (%); m в-ва – масса вещества или соли (г); m р-ра – масса раствора (г)
Физминутка
Решение задач В 513 грамм дистиллированной воды растворили 20 грамм соли. Вычислите массовую долю растворенного вещества в полученном растворе? Дано: Решение: m(H 2 O) =513 г 1. Вычисляем, массу раствора: m (соли)=20 г w- ? 2. Вычисляем массовую долю по формуле:
Я узнал… Я знаю… Я могу… Вызвало затруднение… Мне это пригодится…
СПАСИБО за урок!
Предварительный просмотр:
Технологическая карта урока
Тема урока: «Растворы. Вычисление массовой доли растворённого вещества в растворе» (1 час)
Класс: 8а
Учитель: Хуурак Аяна Хемчикеевна
Тип урока: урок открытия новых знаний
Цель урока:
Задачи:
1.На систему знаний: сформировать знания о растворах и массовой доле растворённого вещества.
2. На систему специальных умений:
а) объяснять понятия «раствор», «растворённое вещество», «растворитель»;
б) уметь вычислять массу раствора, массовую долю растворённого вещества в растворе, массу растворённого вещества.
3. На систему общеспециальных умений:
а) работать с текстом учебника;
б) составлять алгоритм решения задачи;
в) уметь производить необходимые расчёты для нахождения массовой доли растворённого вещества.
4. На систему общеучебных умений и навыков:
а) уметь анализировать, сравнивать, обобщать и делать выводы
Планируемые результаты учебного занятия:
Предметные: умение давать определение понятию «раствор», знание формулы для расчета массовой доли вещества в растворе, умение вычислять массовую долю вещества в растворе, массу раствора, массу растворенного вещества.
Метапредметные:
регулятивные: умение планировать и регулировать свою деятельность, самостоятельно планировать пути достижения цели, владение основами самоконтроля и самооценки;
коммуникативные: готовность получать необходимую информацию, отстаивать свою точку зрения в диалоге и в выступлении, выдвигать гипотезу, доказательства, продуктивно взаимодействовать со своими партнерами, владение устной и письменной речью;
познавательные: умение определять понятия, устанавливать аналогии, строить логические рассуждения и делать выводы, производить поиск информации, анализировать и оценивать её достоверность.
Личностные: принятие социальной роли обучающегося, развитие мотивов учебной деятельности и формирование личностного смысла обучения, социальных и межличностных отношений.
Используемая технология: ИКТ, технология обучения в сотрудничестве.
Информационно-технологические ресурсы: Г.Е. Рудзитис, Ф.Г. Фельдман. Химия: учебник для 8 класса общеобразовательных организаций/. Г.Е. Рудзитис, Ф.Г. Фельдман - 3-е изд.- М: «Просвещение», 2015.- 207 с., Периодическая система химических элементов Д.И.Менделеева, компьютер, мультимедиапроектор, презентация.
Этапы урока:
- Изучение нового материала и решение проблемы.
- Физкультминутка.
- Первичное закрепление.
- Домашнее задание.
- Рефлексия.
Ход урока:
- Мотивационо-информационный. Постановка проблемы.
Присутствие и готовность учащихся к уроку.
- Приветствие, создание положительного эмоционального настроя.
Здравствуйте, садитесь. Хочу начать урок следующими словами:
Если ты, придя с мороза,
Наливаешь крепкий чай,
Хорошенько сахарозу
в чашке ложкой размешай.
Сейчас я предлагаю вам решить следующую задачу:
Бабушка внукам на завтрак приготовила чай, один попросил положить в стакан 2 чайные ложки сахара, а второй – 2 кусочка сахара-рафинада. Определите, не пробуя на вкус, в каком стакане чай слаще? (Чтение задачи сопровождается показом слайдов, слайд 3).
Будете работать в парах.
Дети: работают в парах.
- Я вижу удивление в ваших глазах, вы не знаете, как это сделать? Прежде всего, посмотрите на чай с сахаром с точки зрения химии.
Обсудите в парах и запишите ответы на вопросы:
– Что вы понимаете под словосочетанием «сладкий чай» с точки зрения химии?
– Почему вы не можете сразу ответить на вопрос задачи?
– Каких знаний или умений вам не хватает?
Исходя из ваших ответов, сформулируйте тему урока.
(Дети работают в парах, отвечают на вопросы, затем идёт коллективное обсуждение ответов отдельных пар, учитель комментирует ответы, подводит к теме урока)
Итак, тема нашего урока «Растворы. Вычисление массовой доли растворённого вещества в растворе».
Запишите сегодняшнее число и тему урока .
Что вам нужно знать на уроке?
Какая цель нашего урока?
Цель: формирование знаний о растворах, массовой доле растворенного вещества.
- Планирование решения проблемы и достижения цели урока.
Теперь давайте составим последовательность наших действий для достижения цели урока (формулируется в совместной беседе с учащимися, затем высвечивается на слайде 4):
План урока:
1. Вспомнить, что мы уже знаем по этой теме.
2. Узнать, как найти содержание растворённого вещества в растворе.
3. Узнать количественные данные для решения задачи.
4. Решить предложенную задачу.
5. Применить полученные знания при решении других задач.
- Актуализация знаний учащихся.
Сейчас обсуждаем этапов работы, решаем проблемных ситуаций. Работаем с учебником. Откройте учебники страница 110 параграф 33.
- Вспомним, что мы уже знаем по этой теме.
Ответим на вопросы:
О чём идёт речь в задаче, поставленной в начале урока? (о чае с сахаром)
Так что же такое чай с сахаром с точки зрения химии? (раствор)
Из чего состоит любой раствор? (из растворённого вещества и растворителя)
Что в нём является растворителем, а что растворённым веществом? (растворитель – вода, растворенное вещество – сахар)
Давайте запишем в тетрадях.
Слайд 1Растворы – это однородные системы, состоящие из молекул растворителя и частиц растворенного вещества, между которыми происходят физические и химические взаимодействия.
Слайд 2. Какие бывают растворы?
Слайд 3. Растворимость веществ.
- Изучение нового материала и решение проблемы. Обсуждаем 2 и 3 этапы работы. Работаем с учебником, откройте с.114 параграф 34.
Узнайте, как найти содержание растворённого вещества в растворе, количественные данные для решения задачи (стр. 127-130 учебника, 6 слайд презентации) и решите задачу. (работа с учебником в парах: вывод формулы, решение задачи).
Итак, смогли ли вы ответить на вопрос: «В каком стакане чай слаще?»
Кто хочет проверить это опытным путём? (Один пробует чай на вкус в обоих стаканах).
Сейчас продолжите предложения (слайд 9):
1. Раствор состоит из…
2. Растворителем может быть….
3. Для того, чтобы приготовить раствор заданной концентрации, необходимо знать….
Запишите в тетрадях.
Сейчас ответьте на следующий вопрос? Как выражают содержание вещества в растворе? (массовых долях)
Запишите формулу для вычисления массовой доли растворённого вещества на доске.
А почему в одном стакане чай слаще? (зависит от массы растворенного вещества).
- Физкультминутка. (слайд).
- Первичное закрепление.
Давайте решим задачи. Чтобы решить данную задачу, нам нужно записать условия задачи.
Домашнее задание.
Рефлексия.
Даже в одном грамме вещества может содержаться до тысячи различных соединений. Каждое соединение отвечает за определенное свойство вещества, а бывает так, что это не определенное вещество, а смесь. В любом случае на производстве часто возникает ситуация утилизации химических отходов и задача использования вторичного сырья. Именно химические реакции, позволяющие найти и выделить определенное вещество являются главенствующими. Но для этого надо сначала узнать как найти массовую долю.
Понятие массовой доли вещества отражает его содержание и концентрацию в сложной химической структуре, будь то смесь или сплав. Зная общую массу сплава или смеси, можно найти массы составляющих их веществ, при условии, что известны их массовые доли. Как найти массовую долю, формула обычно выражается в виде дроби: массовая доля вещества масса вещества/масса всей смеси.
Давайте проведем небольшой эксперимент! Для этого нам понадобятся периодическая таблица химических элементов им. Менделеева, весы и калькулятор.
Как найти массовую долю вещества
Необходимо определить массовую долю вещества, вещество находится в виде смеси. Первоначально кладем на весы само вещество. Получили массу вещества. Зная определенную массу вещества в смеси мы с легкостью получим его массовую долю. К примеру есть 170г. воды. В них находится 30 грамм вишневого сока. Общая масса=170+30=230 грамм. Поделим массу вишневого сока к общей массе смеси: 30/200=0.15 или 15% .
Как найти массовую долю раствора
Решение данной проблемы может понадобиться при определении концентрации пищевых растворов(уксус) или лекарственных препаратов. Дана масса раствора KOH, он же гидроксид калия, массой в 400 грамм. KOH (масса самого вещества) составляет 80 грамм. Необходимо найти массовую долю желчи в полученном растворе. Формула нахождения решения: KOH (масса раствора гидроксида калия) 300 г, масса растворенного вещества (KOH) 40 г. Найдите KOH (массовую долю щелочи) в полученном растворе, t- массовая доля. m- масса, t (вещества) = 100%* m (вещества) / m (раствора (вещества). Таким образом KOH (массовая доля раствора гидроксида калия): t (KOH) = 80 г /400 г х 100% = 20 %.
Как найти массовую долю углерода в углеводороде
Для этого используем таблицу Менделеева. Ищем вещества в таблице. В таблице приведена атомная масса элементов. 6 углеродов с атомной массой 12 и 12 водородов с атомной массой равной 1. m (C6H12) = 6 х 12 + 12 х 1= 84 г/моль, ω (С) = 6 m1(С) / m (C6H12) = 6 х 12 / 84 = 85%
Определение массовой доли на производствах производится в специальных химических лабораториях. Для начала берется небольшой образец, на который испытывают различные химические реакции. Или внедряют лакмусовые бумажки, которые могут показать наличие того или иного компонента. После выяснения первоначальной структуры вещества можно начинать выделение компонентов. Это достигается за счет простых химических реакций, когда одно вещество контактирует с другим и получается новое, возможен осадок. Существуют и более продвинутые способы, такие как электролиз, нагревание, охлаждение, выпаривание. Для подобных реакций нужно большое промышленное оборудование. Производство, конечно, тяжело назвать экологически чистым, тем не менее современные технологии обработки отходов позволяют минимизировать нагрузку на природу.