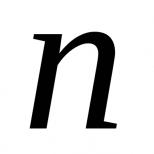Свойства и получение фенола. Фенол, его строение, химические свойства, применение. Роль фенолов в природе
Фенолы.
1. Определение. Классификация.
2. Номенклатура и изомерия. Основные представители
3. Получение
4. Физические свойства
5. Химические свойства
6. Применение. Влияние на здоровье человека.
Фенолы – это производные бензола с одной или нескольким гидроксильными группами.
Классификация.
В зависимости от числа гидроксигрупп фенолы разделяются по атомности на: одно-, двух - и трехатомные.
По степени летучести веществ их принято делить на две группы - летучие с паром фенолы (фенол, крезолы, ксиленолы, гваякол, тимол) и нелетучие фенолы (резорцин, пирокатехин, гидрохинон, пирогаллол и другие многоатомные фенолы). Строение и номенклатуру отдельных представителей рассмотрим ниже.

Номенклатура и изомерия. Основные представители.
Первого представителя, как правило, называют по тривиальной номенклатуре, фенол (оксибензол, устар. карболовая кислота).
https://pandia.ru/text/78/359/images/image005_11.gif" width="409" height="104">
3,5-диметилфенол 4-этилфенол
Часто для фенолов разной степени замещенности употребляют тривиальные названия.
Получение
1) Выделение из продуктов сухой каменноугольной смолы, а также из продуктов пиролиза бурых углей и древесины (деготь).
2) Через бензолсульфокислоту. Сначала бензол обрабатывают при нагревании концентрированной серной кислотой
C6H6 + H2SO4 = C6H5SO3H + H2O
Полученную бензолсульфокислоту сплавляют со щёлочью
C6H5SO3H + 3NaOH = C6H5ONa + 2H2O + Na2SO3
После обработки фенолята сильной кислотой получают фенол.
3) Кумольный способ (основан на окислении ароматического углеводорода кумола (изопропилбензол) кислородом воздуха с последующим разложением получающейся гидроперекиси, разбавленной H2SO4). Реакция проходит с высоким выходом и привлекательна тем, что позволяет получить сразу два технически ценных продукта – фенол и ацетон (нужно рассмотреть самостоятельно).
Физические свойства
Фено́л представляет собой бесцветные игольчатые кристаллы, розовеющие на воздухе из-за окисления, приводящего к окрашенным продуктам. Обладают специфическим запахом гуаши. Растворим в воде (6 г на 100 г воды), в растворах щелочей, в спирте, в бензоле, в ацетоне.
При работе с фенолом необходимо соблюдать технику безопасности : работать под вытяжкой, использовать средства индивидуальной защиты, т. к. при попадании на кожу вызывает ожоги.
Химические свойства фенолов
Строение молекулы фенола
Бензольное кольцо и ОН-группа, объединенные в молекуле фенола, влияют друг на друга, взаимно повышая реакционную способность друг друга. Фенильная группа оттягивает на себя неподеленную электронную пару от атома кислорода в ОН-группе.
https://pandia.ru/text/78/359/images/image007_10.gif" width="348" height="62">
Каталитическое взаимодействие со спиртами приводит к простым эфирам, а в результате реакции с ангидридами или хлорангидридами карбоновых кислот образуются сложные эфиры. Это реакции, аналогичные реакциям спиртов, которые были изучены на прошлой лекции (еще их называют о-алкилирование и о-ацилирование).


2. Реакции с отрывом ОН-группы
При взаимодействии с аммиаком (при повышенной температуре и давлении) происходит замена ОН-группы на NH2, образуется анилин.

3. Реакции замещения атомов водорода в бензольном кольце
(реакции электрофильного замещения) .
ОН-группа является активирующим ориентантом I рода. поэтому при галогенировании, нитровании, сульфировании и алкилировании фенола атакуются центры с повышенной электронной плотностью, т. е. замещение проходят преимущественно в орто- и пара- положениях. Подробно такие реакции были изучены в лекции о правилах ориентации в бензольном кольце.
Реакции фенолов с галогенами протекают быстро, без катализаторов.

о-хлор- и п-хлорфенол
Фенол при действии конц. HNO 3 превращается в 2,4,6-тринитрофенол (пикриновая кислота). Нитрование сопровождается окислением, поэтому выход продукта невысок.

Мононитрофенолы образуются при нитровании фенола разбавленной азотной кислотой (при комнатной температуре).

о-нитро- и п-нитрофенол
Фенол легко сульфируется концентрированной H 2 SO 4, при этом при температуре 15-20оС преимущественно получается о-изомер, а при 100оС – п-изомер.

о-фенол- и п-фенолсульфокислоты
Фенолы также легко подвергаются алкилированию и ацилированию в ядро.

Одна из наиболее ярких реакций – это нагревание фенолов с фталевым ангидридом в присутствии серной кислоты, которая ведет к получению триарилметиленовых красителей, называемых фенолфталеинами.
Аспирин" href="/text/category/aspirin/" rel="bookmark">аспирина . Феноляты натрия и калия взаимодействуют с СО2. При температуре 125оС получается о - изомер фенолкарбоновой кислоты, который ацилируется по ОН-группе, с образованием аспирина.

Важно отметить еще две качественные реакции фенолов:
1) Реакция фенолов с бромом : она протекает очень быстро и остановить ее на стадии монобромирования весьма затруднительно. В результате образуется 2.4.6-трибромфенол – осадок белого цвета.

Реакция применяется для обнаружения фенола в воде: помутнение заметно даже при крайне незначительном содержании фенола в воде (1:100000).
2) Реакция с солями Fe (III). Реакция основана на образовании комплексов фенолятов железа, имеющих фиолетовую окраску.
https://pandia.ru/text/78/359/images/image023_0.gif" width="204" height="49">
Гидрирование водородом в присутствии никелевого катализатора оказывает действие на ароматическое кольцо, восстанавливая именно его.

4. Окисление фенолов
Фенолы чувствительны к действию окислителей. Под действием хромовой кислоты фенол и гидрохинон окисляются до п-бензохинона, а пирокатехин – до о-бензохинона. Метапроизводные фенола окисляются достаточно сложно.
Отделочные материалы и работы" href="/text/category/otdelochnie_materiali_i_raboti/" rel="bookmark">отделочных материалов , лакокрасочных изделий, декоративной косметики и даже детских игрушек могут пренебречь требованиями безопасности и выпускать продукцию с недопустимо высоким содержанием таких токсичных веществ, как фенолы и их производные.
Поэтому необходимо проявлять бдительность и при первых же симптомах отравления принять меры. Помните, если вас настораживает неприятный запах недавно приобретенной вещи, если вам кажется, что ваше здоровье после покупки мебели или недавнего ремонта пошатнулось, будет лучше вызвать специалиста-эколога, который проведет все нужные исследования и даст необходимые рекомендации, чем пребывать в тревоге и сомнениях, опасаясь за свое здоровье и здоровье своих близких.
Во Вторую мировую войну фенол применялся в концентрационных лагерях Третьего рейха для умерщвления.
Серьезно фенол влияет и на окружающую среду: в незагрязненных или слабозагрязненных речных водах содержание фенолов обычно не превышает 20 мкг/дм3. Превышение естественного фона может служить указанием на загрязнение водоемов . В загрязненных фенолами природных водах содержание их может достигать десятков и даже сотен микрограммов в 1 л. ПДК фенолов в воде для России составляет 0,001 мг/дм3
Анализ воды на фенол важен для природных и сточных вод. Необходимо проверять воду на содержание фенола если есть подозрение в загрязнении водотоков промышленными стоками.
Фенолы - соединения нестойкие и подвергаются биохимическому и химическому окислению . Многоатомные фенолы разрушаются в основном путем химического окисления.
Однако при обработке хлором воды, содержащей примеси фенола, могут образовываться очень опасные органические токсиканты - диоксины .
Концентрация фенолов в поверхностных водах подвержена сезонным изменениям. В летний период содержание фенолов падает (с ростом температуры увеличивается скорость распада). Спуск в водоемы и водотоки фенольных вод резко ухудшает их общее санитарное состояние, оказывая влияние на живые организмы не только своей токсичностью, но и значительным изменением режима биогенных элементов и растворенных газов (кислорода, углекислого газа). В результате хлорирования воды, содержащей фенолы, образуются устойчивые соединения хлорфенолов, малейшие следы которых (0,1 мкг/дм3) придают воде характерный привкус.
Среди антисептических средств, широко применяемых в современной медицине, это вещество занимает значимое место. Применение фенола обусловлено его бактерицидными карбоновая (фенол) получается путем перегонки каменоугольного дегтя. Чистая кислота карбоновая - бесцветная кристаллическая масса. Под действием воздуха она постепенно приобретает розовый оттенок. Применение фенола облегчается тем, что это вещество легко растворяется в воде, эфире, спирте и жирных маслах. Его растворы оказывают хорошее бактерицидное действие по отношению к микроорганизмам (вегетативной форме) и грибам. Слабое влияние они оказывают на споры микроорганизмов. Взаимодействуя с белком клеток микроорганизмов, фенол вызывает его денатурацию, повышает проницаемость мембран клеток, оказывает воздействие на окислительные процессы в клетке. Бактерицидный эффект при повышении температуры и в кислой среде усиливается.
Чаще всего применяют данное вещество в форме 3-5% раствора для дезинфицирования различных поверхностей. Где используется фенол? Его можно применять в домашнем обиходе для дезинфекции предметов, вещей, полов. Этим веществом нельзя обрабатывать лаковую мебель. В медицинских учреждениях его используют для обработки предметов больничного обихода, белья, инструментов. Применение фенола в виде мыльно-карболового раствора позволяет обрабатывать большие площади общественных помещений. Также часто применяют фенольно-скипидарные, фенольно-керосиновые и иные смеси.
Широко его применяют и в фармацевтической практике. Так 0,5-0,1% фенол используют для консервирования свечей, лекарственных средств, сывороток и других препаратов. Применение в медицине фенола возможно при некоторых серьезных кожных заболеваниях (остиофолликулит, сикоз, фолликулит, импетиго стрептококковое), при кондиломах генитальных и при острых воспалениях среднего уха. На слизистые оболочки и кожу фенол оказывает прижигающее и раздражающее действие. Препарат легко всасывается и в высоких дозах способен вызывать такие токсические явления, как слабость, головокружение, коллапс, расстройства дыхания. Его не следует применять при распространенных заболеваниях слизистых и кожи. При использовании данного вещества не стоит забывать о том, что оно легко адсорбируется со всеми пищевыми продуктами.
Применение фенола возможно еще в следующих формах:
Фенол чистый жидкий, состоящий из смеси 100 частей расплавленной кислоты карбоновой и 10 частей воды. Представляет собой розоватую или бесцветную маслянистую жидкость.
3 и 5% раствор кислоты карбоновой в глицерине.
2% феноловая мазь.
Раствор «Фукорцин», содержащий 0,8 частей борной кислоты; 3,9 частей чистого фенола; 7,8 частей резорцина; 0,4 части фуксина; 4,9 частей ацетона; 9,6 частей 95 % этилового спирта; и дистиллированную воду (в количестве, доводящем его до 100 частей). Эта дезинфицирующая жидкость имеет красный цвет и запах фенола. Используется как противогрибковое и антисептическое средство. Выпускается во флаконах с темным стеклом по 25мл.
Препарат «Ферезол» - в которую входит фенол (60%) и трикрезол (40%). Эта коричневого цвета маслянистая жидкость с фенольным запахом оказывает бактерицидное и прижигающее действие. Ее применяют для удаления бородавок, папиллом, остроконечных кондилом, сухих мозолей. Этот препарат используется преимущественно в медицинских учреждениях.
Противопоказания к применению данного вещества: период лактации, гиперчувствительность, детский возраст, беременность, распространенные поражения слизистых и кожных покровов. Побочные явления: жжение, зуд, раздражение кожи. Эти явления устраняются при помощи обработки пораженных участков полиэтиленгликолем или растительным маслом. Хранят фенол в темном месте, в закрытых банках.
Различают одно-, двух-, трехатомные фенолы в зависимости от количества ОН-групп в молекуле (рис.1)
Рис. 1. ОДНО-, ДВУХ- И ТРЕХАТОМНЫЕ ФЕНОЛЫ
В соответствии с количеством конденсированных ароматических циклов в молекуле различают (рис. 2) сами фенолы (одно ароматическое ядро – производные бензола), нафтолы (2 конденсированных ядра – производные нафталина), антранолы (3 конденсированных ядра – производные антрацена) и фенантролы (рис. 2).
Рис. 2. МОНО- И ПОЛИЯДЕРНЫЕ ФЕНОЛЫ
Номенклатура спиртов.
Для фенолов широко используют тривиальные названия, сложившиеся исторически. В названиях замещенных моноядерных фенолов используются также приставки орто- , мета- и пара -, употребляемые в номенклатуре ароматических соединений. Для более сложных соединений нумеруют атомы , входящие в состав ароматических циклов и с помощью цифровых индексов указывают положение заместителей (рис. 3).
Рис. 3. НОМЕНКЛАТУРА ФЕНОЛОВ . Замещающие группы и соответствующие цифровые индексы для наглядности выделены различными цветами.
Химические свойства фенолов.
Бензольное ядро и ОН-группа, объединенные в молекуле фенола, влияют друг на друга, существенно повышая реакционную способность друг друга. Фенильная группа оттягивает на себя неподеленную электронную пару от атома кислорода в ОН-группе (рис. 4). В результате на атоме Н этой группы увеличивается частичный положительный заряд (обозначен значком d+), полярность связи О–Н возрастает, что проявляется в увеличении кислотных свойств этой группы. Таким образом, в сравнении со спиртами, фенолы представляют собой более сильные кислоты. Частичный отрицательный заряд (обозначен через d–), переходя на фенильную группу, сосредотачивается в положениях орто- и пара- (по отношению к ОН-группе). Эти реакционные точки могут атаковаться реагентами, тяготеющими к электроотрицательным центрам, так называемыми электрофильными («любящими электроны») реагентами.
Рис. 4. РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОННОЙ ПЛОТНОСТИ В ФЕНОЛЕ
В итоге для фенолов возможны два типа превращений: замещение атома водорода в ОН-группе и замещение Н-атомобензольном ядре. Пара электронов атома О, оттянутая к бензольному кольцу, увеличивает прочность связи С–О, поэтому реакции, протекающие с разрывом этой связи, характерные для спиртов, для фенолов не типичны.
1. Реакции замещения атома водорода в ОН-группе. При действии на фенолы щелочей образуются феноляты (рис. 5А), каталитическое взаимодействие со спиртами приводит к простым эфирам (рис. 5Б), а в результате реакции с ангидридами или хлорангидридами карбоновых кислот образуются сложные эфиры (рис. 5В). При взаимодействии с аммиаком (повышенная температура и давление) происходит замена ОН-группы на NH 2 , образуется анилин, (рис. 5Г), восстанавливающие реагенты превращают фенол в бензол (рис. 5Д)
2. Реакции замещения атомов водорода в бензольном кольце.
При галогенировании, нитровании, сульфировании и алкилировании фенола атакуются центры с повышенной электронной плотностью (рис.4), т.е. замещение проходят преимущественно в орто- и пара- положениях (рис.6).
При более глубоком протекании реакции происходит замещение двух и трех атомов водорода в бензольном кольце.
Особое значение имеют реакции конденсации фенолов с альдегидами и кетонами, по существу, это алкилирование, проходящее легко и в мягких условиях (при 40–50° С, водная среда в присутствии катализаторов), при этом атом углерода в виде метиленовой группы СН 2 или замещенной метиленовой группы (CНR либо CR 2) встраивается между двумя молекулами фенола. Часто такая конденсация приводит к образованию полимерных продуктов (рис. 7).
Двухатомный фенол (торговое название бисфенол А, рис.7), используют в качестве компонента при получении эпоксидных смол. Конденсация фенола с формальдегидом лежит в основе производства широко применяемых феноло-формальдегидных смол (фенопласты).
Способы получения фенолов.
Фенолы выделяют из каменноугольной смолы, а также из продуктов пиролиза бурых углей и древесины (деготь). Промышленный способ получения самого фенола С 6 Н 5 ОН основан на окислении ароматического углеводорода кумола (изопропилбензол) кислородом воздуха с последующим разложением получающейся гидроперекиси, разбавленной H 2 SO 4 (рис. 8А). Реакция проходит с высоким выходом и привлекательна тем, что позволяет получить сразу два технически ценных продукта – фенол и ацетон. Другой способ – каталитический гидролиз галогензамещенных бензолов (рис. 8Б).
Рис. 8. СПОСОБЫ ПОЛУЧЕНИЯ ФЕНОЛА
Применение фенолов.
Раствор фенола используют в качестве дезинфицирующего средства (карболовая кислота). Двухатомные фенолы – пирокатехин, резорцин (рис. 3), а также гидрохинон (пара- дигидроксибензол) применяют как антисептики (антибактериальные обеззараживающие вещества), вводят в состав дубителей для кожи и меха, как стабилизаторы смазочных масел и резины, а также для обработки фотоматериалов и как реагенты в аналитической химии.
В виде отдельных соединений фенолы используются ограниченно, зато их различные производные применяют широко. Фенолы служат исходными соединениями для получения разнообразных полимерных продуктов – феноло-альдегидных смол (рис. 7), полиамидов, полиэпоксидов. На основе фенолов получают многочисленные лекарственные препараты, например, аспирин, салол, фенолфталеин, кроме того, красители, парфюмерные продукты, пластификаторы для полимеров и средства защиты растений.
Михаил Левицкий
Гидроксильная группа в молекулах органических соединений может быть связана с ароматическим ядром непосредственно, а может быть отделена от него одним или несколькими атомами углерода. Можно ожидать, что в зависимости от этого свойства вещества будут существенно отличаться друг от друга из-за взаимного влияния групп атомов. И действительно, органические соединения, содержащие ароматический радикал фенил С 6 Н 5 -, непосредственно связанный с гидроксильной группой, проявляют особые свойства , отличные от свойств спиртов. Такие соединения называются фенолами .
Органические вещества, молекулы которых содержат радикал фенил, связанный с одной или несколькими гидроксогруппами. Так же как и спирты, фенолы классифицируют по атомности, т. е. по количеству гидроксильных групп.
Одноатомные фенолы содержат в молекуле одну гидроксильную группу:

Многоатомные фенолы содержат в молекулах более одной гидроксильной группы:

Существуют и другие многоатомные фенолы, содержащие три и более гидроксильных групп в бензольном кольце.
Познакомимся подробнее со строением и свойствами простейшего представителя этого класса - фенолом С 6 Н 5 ОН. Название этого вещества и легло в основу названия всего класса - фенолы.

Фенол - твердое, бесцветное кристаллическое вещество, t° = 43 °С, t° = 181 °С, с резким характерным запахом. Ядовит . Фенол при комнатной температуре незначительно растворяется в воде. Водный раствор фенола называют карболовой кислотой. При попадании на кожу он вызывает ожоги , поэтому с фенолом необходимо обращаться осторожно!


Химические свойства фенолов
Кислотные свойства . Атом водорода гидроксильной группы обладает кислотным характером. Кислотные свойства у фенола выражены сильнее , чем у воды и спиртов. В отличие от спиртов и воды, фенол реагирует не только с щелочными металлами, но и со щелочами с образованием фенолятов :

Однако кислотные свойства у фенолов выражены слабее, чем у неорганических и карбоновых кислот. Так, например, кислотные свойства фенола примерно в 3000 раз меньше, чем у угольной кислоты. Поэтому, пропуская через водный раствор фенолята натрия углекислый газ, можно выделить свободный фенол.

Добавление к водному раствору фенолята натрия соляной или серной кислоты также приводит к образованию фенола:

Фенол реагирует с хлоридом железа (III) с образованием интенсивно окрашенного в фиолетовый цвет комплексного соединения.
Эта реакция позволяет обнаруживать его даже в очень ограниченных количествах. Другие фенолы, содержащие одну или несколько гидроксильных групп в бензольном кольце, также дают яркое окрашивание сине-фиолетовых оттенков в реакции с хлоридом железа (III).

Наличие гидроксильного заместителя значительно облегчает протекание реакций электрофильного замещения в бензольном кольце.
1. Бромирование фенола.
В отличие от бензола для бромирования фенола не требуется добавления катализатора (бромида железа (III)). Кроме того, взаимодействие с фенолом протекает селективно (избирательно): атомы брома направляются в орто- и параположения, замещая находящиеся там атомы водорода. Селективность замещения объясняется рассмотренными выше особенностями электронного строения молекулы фенола.
Так, при взаимодействии фенола с бромной водой образуется белый осадок 2,4,6-трибромфенола:

Эта реакция, так же как и реакция с хлоридом железа (III), служит для качественного обнаружения фенола.
2. Нитрование фенола также происходит легче, чем нитрование бензола. Реакция с разбавленной азотной кислотой идет при комнатной температуре. В результате образуется смесь орто- и параизомеров нитрофенола:

При использовании концентрированной азотной кислоты образуется 2,4,6-тринитрофенол - пикриновая кислота, взрывчатое вещество:

3. Гидрирование ароматического ядра фенола в присутствии катализатора происходит легко:

4. Поликонденсация фенола с альдегидами , в частности, с формальдегидом происходит с образованием продуктов реакции - фенолформальдегидных смол и твердых полимеров.
Взаимодействие фенола с формальдегидом можно описать схемой:

В молекуле димера сохраняются «подвижные» атомы водорода, а значит, возможно дальнейшее продолжение реакции при достаточном количестве реагентов:

Реакция поликонденсации, т. е. реакция получения полимера, протекающая с выделением побочного низкомолекулярного продукта (воды), может продолжаться и далее (до полного израсходования одного из реагентов) с образованием огромных макромолекул. Процесс можно описать суммарным уравнением:

Образование линейных молекул происходит при обычной температуре. Проведение же этой реакции при нагревании приводит к тому, что образующийся продукт имеет разветвленное строение, он твердый и нерастворим в воде. В результате нагревания фенолформальдегидной смолы линейного строения с избытком альдегида получаются твердые пластические массы с уникальными свойствами. Полимеры на основе фенолформальдегидных смол применяют для изготовления лаков и красок, пластмассовых изделий, устойчивых к нагреванию, охлаждению, действию воды, щелочей и кислот. Они обладают высокими диэлектрическими свойствами. Из полимеров на основе фенолформальдегидных смол изготавливают наиболее ответственные и важные детали электроприборов, корпуса силовых агрегатов и детали машин, полимерную основу печатных плат для радиоприборов. Клеи на основе фенолформальдегидных смол способны надежно соединять детали самой различной природы, сохраняя высочайшую прочность соединения в очень широком диапазоне температур. Такой клей применяется для крепления металлического цоколя ламп освещения к стеклянной колбе. Таким образом, фенол и продукты на его основе находят широкое применение.


Профильный химико-биологический класс
Тип урока: урок изучения нового материала.
Методы ведения урока:
- словесные (беседа, объяснение, рассказ);
- наглядные (компьютерная презентация);
- практические (демонстрационные опыты, лабораторные опыты).
Цели урока: Обучающие цели: на примере фенола конкретизировать знания учащихся об особенностях строения веществ, принадлежащих к классу фенолы, рассмотреть зависимость взаимного влияния атомов в молекуле фенола на его свойства; познакомить учащихся с физическими и химическими свойствами фенола и некоторых его соединений, изучить качественные реакции на фенолы; рассмотреть нахождение в природе, применение фенола и его соединений, их биологическую роль
Воспитывающие цели: Создать условия для самостоятельной работы учащихся, укреплять навыки работы учащихся с текстом, выделять основное в тексте, выполнять тесты.
Развивающие цели: Создать на уроке диалоговое взаимодействие, содействовать развитию умений учащихся высказывать свое мнение, выслушивать товарища, задавать друг другу вопросы и дополнять выступления друг друга.
Оборудование: мел, доска, экран, проектор, компьютер, электронные носители, учебник «Химия», 10 кл., О.С. Габриелян, Ф.Н. Маскаев, учебник «Химия: в тестах, задачах и упражнениях», 10 кл., О.С. Габриелян, И.Г. Остроумов.
Демонстрация: Д. 1. Вытеснение фенола из фенолята натрия угольной кислотой.
Д. 2. Взаимодействие фенола и бензола с бромной водой (видеоролик).
Д. 3. Реакция фенола с формальдегидом.
Лабораторный опыт: 1. Растворимость фенола в воде при обычной и повышенной температуре.
2. Взаимодействие фенола и этанола с раствором щелочи.
3. Реакция фенола с FeCl 3 .
Скачать:
Предварительный просмотр:
МУНИЦИПАЛЬНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«ГИМНАЗИЯ №5»
г. ТЫРНЫАУЗА КБР
Открытый урок-исследование по химии
Учитель химии: Грамотеева С.В.
I квалификационной категории
Класс: 10 «А», химико-биологический
Дата: 14.02.2012
Фе нол: строение, физические и химические свойства фено ла.
Примене ние фенола.
Профильный химико-биологический класс
Тип урока: урок изучения нового материала.
Методы ведения урока:
- словесные (беседа, объяснение, рассказ);
- наглядные (компьютерная презентация);
- практические (демонстрационные опыты, лабораторные опыты).
Цели урока: Обучающие цели: на примере фенола конкретизировать знания учащихся об особенностях строения веществ, принадлежащих к классу фенолы, рассмотреть зависимость взаимного влияния атомов в молекуле фенола на его свойства; познакомить учащихся с физическими и химическими свойствами фенола и некоторых его соединений, изучить качественные реакции на фенолы; рассмотреть нахождение в природе, применение фенола и его соединений, их биологическую роль
Воспитывающие цели: Создать условия для самостоятельной работы учащихся, укреплять навыки работы учащихся с текстом, выделять основное в тексте, выполнять тесты.
Развивающие цели: Создать на уроке диалоговое взаимодействие, содействовать развитию умений учащихся высказывать свое мнение, выслушивать товарища, задавать друг другу вопросы и дополнять выступления друг друга.
Оборудование: мел, доска, экран, проектор, компьютер, электронные носители, учебник «Химия», 10 кл., О.С. Габриелян, Ф.Н. Маскаев, учебник «Химия: в тестах, задачах и упражнениях», 10 кл., О.С. Габриелян, И.Г. Остроумов.
Демонстрация: Д. 1. Вытеснение фенола из фенолята натрия угольной кислотой.
Д. 2. Взаимодействие фенола и бензола с бромной водой (видеоролик).
Д. 3. Реакция фенола с формальдегидом.
Лабораторный опыт: 1. Растворимость фенола в воде при обычной и повышенной температуре.
3. Реакция фенола с FeCl 3 .
ХОД УРОКА
- Организационный момент.
- Подготовка к изучению нового материала.
- Фронтальный опрос:
- Какие спирты называются многоатомными? Приведите примеры.
- Каковы физические свойства многоатомных спиртов?
- Какие реакции характерны для многоатомных спиртов?
- Напишите качественные реакции, характерные для многоатомных спиртов.
- Приведите примеры реакции этерификации этиленгликоля и глицерина с органическими и неорганическими кислотами. Как называются продукты реакций?
- Напишите реакции внутримолекулярной и межмолекулярной дегидратации. Назовите продукты реакций.
- Напишите реакции взаимодействия многоатомных спиртов с галогеноводородами. Назовите продукты реакций.
- Каковы способы получения этиленгликоля?
- Каковы способы получения глицерина?
- Каковы области применения многоатомных спиртов?
- Проверка дом. задания: стр. 158, упр. 4-6 (выборочно у доски).
- Изучение нового материала в форме беседы.
На слайде представлены структурные формулы органических соединений. Вам необходимо назвать эти вещества и, определить к какому классу они принадлежат.
Фенолы – это вещества, в которых гидроксогруппа соединена непосредственно с бензольным кольцом.
Назовите молекулярную формулу фенил-радикала: C 6 H 5 – фенил. Если к этому радикалу присоединить одну или несколько гидроксильных групп, то мы получим фенолы. Обратите внимание на то, что гидроксильные группы должны быть непосредственно связаны с бензольным кольцом, в противном случае мы получим ароматические спирты.
Классификация
Так же как и спирты, фенолы классифицируют по атомности , т.е. по количеству гидроксильных групп.
- Одноатомные фенолы, содержат в молекуле одну гидроксильную группу:
- Многоатомные фенолы содержат в молекулах более одной гидроксильной группы:
Самый главный представитель этого класса – фенол. Название этого вещества и легло в основу названия всего класса – фенолы.
Многие из вас в скором будущем станут врачами, поэтому о феноле они должны знать как можно больше. В настоящее время можно выделить несколько основных направлений использования фенола. Один из них – производство лекарственных средств. Большинство этих лекарств - производные получаемой из фенола салициловой кислоты: o-HOC 6 H 4 COOH. Самое распространенное жаропонижающее - аспирин не что иное, как ацетилсалициловая кислота. Эфир салициловой кислоты и самого фенола тоже хорошо известен под названием салол. При лечении туберкулеза применяют парааминосалициловую кислоту (сокращенно ПАСК). Ну и, наконец, при конденсации фенола с фталевым ангидридом получается фенолфталеин, он же пурген.
Фенолы – органические вещества, молекулы которых содержат радикал фенил, связанные с одной или несколькими гидроксигруппами.
Как вы считаете, почему фенолы выделили в отдельный класс, хотя они содержат ту же гидроксильную группу, что и спирты?
Их свойства сильно отличаются от свойств спиртов. Почему?
Атомы в молекуле взаимно влияют друг на друга. (Теория Бутлерова).
Рассмотрим свойства фенолов на примере простейшего фенола.
История открытия
В 1834г. немецкий химик-органик Фридлиб Рунге обнаружил в продуктах перегонки каменноугольной смолы белое кристаллическое вещество с характерным запахом. Ему не удалось определить состав вещества, сделал это в 1842г. Огюст Лоран. Вещество обладало выраженными кислотными свойствами и было производным открытого незадолго до этого бензола. Лоран назвал его бензол феном, поэтому новая кислота получила название фениловой. Шарль Жерар считал полученное вещество спиртом и предложил называть его фенолом.
Физические свойства
Лабораторный опыт: 1. Изучение физических свойств фенола.
Инструктивная карточка
1.Рассмотрите выданное вам вещество и пишите его физические свойства.
2.Растворите вещество в холодной воде.
3.Слегка нагрейте пробирку. Отметьте наблюдения.
Фенол C 6 H 5 OH (карболовая кислота) - бесцветное кристаллическое вещество, t пл = 43 0 C, t кип = 182 0 C, на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 °C смешивается с водой в любых соотношениях. Фенол - токсичное вещество, вызывает ожоги кожи, является антисептиком, поэтому с фенолом необходимо обращаться осторожно !
Сам фенол и его пары ядовиты. Но существуют фенолы растительного происхождения, содержащиеся, например, в чае. Они благоприятно действуют на организм человека.
Следствием полярности связи О–Н и наличия неподеленных пар электронов на атоме кислорода является способность гидроксисоединений к образованию водородных связей
Это объясняет, почему у фенола довольно высокие температуры плавления (+43) и кипения (+182). Образование водородных связей с молекулами воды способствует растворимости гидроксисоединений в воде.
Способность растворяться в воде уменьшается с увеличением углеводородного радикала и от многоатомных гидроксисоединений к одноатомным. Метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин смешиваются с водой в любых соотношениях. Растворимость фенола в воде ограничена.
Изомерия и номенклатура
Возможны 2 типа изомерии :
- изомерия положения заместителей в бензольном кольце;
- изомерия боковой цепи (строения алкильного радикала и числа радикалов ).
Химические свойства
Посмотрите внимательно на структурную формулу фенола и ответьте на вопрос: «Что такого особенного в феноле, что его выделили в отдельный класс?»
Т.е. фенол содержит и гидроксильную группу и бензольное кольцо, которые, согласно третьему положению теории А.М. Бутлерова, влияют друг на друга.
Свойствами каких соединений формально должен обладать фенол? Правильно, спиртов и бензола.
Химические свойства фенолов обусловлены именно наличием в молекулах функциональной гидроксильной группы и бензольного кольца. Поэтому химические свойства фенола можно рассмотреть как по аналогии со спиртами, так и по аналогии с бензолом.
Вспомните, с какими веществами реагируют спирты. Посмотрим видеоролик взаимодействие фенола с натрием.
- Реакции с участием гидроксильной группы.
- Взаимодействие мо щелочными металлами (сходство со спиртами).
2C 6 H 5 OH + 2Na → 2C 6 H 5 ONa + H 2 (фенолят-натрия)
Вспомните реагируют ли спирты со щелочами? Нет, а фенол? Проведем лабораторный опыт.
Лабораторный опыт: 2. Взаимодействие фенола и этанола с раствором щелочи.
1. В первую пробирку налейте раствор NaOH и 2-3 капли фенолфталеина, затем добавьте 1\3 часть раствора фенола.
2. Во вторую пробирку добавьте раствор NaOH и 2-3 капли фенолфталеина, затем добавьте 1\3 часть этанола.
Оформите наблюдения и напишите уравнения реакций.
- Атом водорода гидроксильной группы фенола обладает кислотным характером. Кислотные свойства у фенола выражены сильнее, чем у воды и спиртов. В отличие от спиртов и воды фенол реагирует не только со щелочными металлами, но со щелочами с образованием фенолятов:
C 6 H 5 OH + NaOH → C 6 H 5 ONa + H 2 O
Однако кислотные свойства у фенолов выражены слабее, чем у неорганических и карбоновых кислот. Так, например, кислотные свойства фенола примерно в 3000 раза меньше, чем у угольной кислоты, поэтому пропуская через раствор фенолята натрия углекислый газ, можно выделить свободный фенол (демонстрация ):
C 6 H 5 ONa + H 2 O + CO 2 → C 6 H 5 OH + NaHCO 3
Добавление к водному раствору фенолята натрия соляной или серной кислоты также приводит к образованию фенола:
C 6 H 5 ONa + HCl → C 6 H 5 OH + NaCl
Феноляты используются в качестве исходных веществ для получения простых и сложных эфиров:
C 6 H 5 ONa + C 2 H 5 Br → C 6 H 5 OC 2 H 5 + NaBr (этифениловый эфир)
C 6 H 5 ONa + CH 3 COCl → CH 3 – COOC 6 H 5 + NaCl
Ацетилхлорид фенилацетат, фениловый эфир уксусной кислоты
Как можно объяснить то, что спирты с растворами щелочей не реагируют, а фенол реагирует?
Фенолы представляют собой полярные соединения (диполи). Бензольное кольцо является отрицательным концом диполя, группа - OH - положительным. Дипольный момент направлен в сторону бензольного кольца.
Бензольное кольцо перетягивает электроны неподеленной пары электронов кислорода. Смещение неподелённой пары электронов атома кислорода в сторону бензольного кольца приводит к увеличению полярности связи O-H. Увеличение полярности связи O-H под действием бензольного ядра и появление достаточно большого положительного заряда на атоме водорода приводит к тому, что молекула фенола диссоциирует в водных растворах по кислотному типу:
C 6 H 5 OH ↔ C 6 H 5 O - + H + (фенолят-ион)
Фенол является слабой кислотой . В этом состоит главное отличие фенолов от спиртов , которые являются неэлектролитами .
- Реакции с участием бензольного кольца
Бензольное кольцо изменило свойства гидроксогруппы!
Есть ли обратное влияние – изменились ли свойства бензольного кольца?
Проведем еще один опыт.
Демонстрация: 2. Взаимодействие фенола с бромной водой (видеоролик).
Реакции замещения . Реакции электрофильного замещения в бензольном кольце фенолов протекают значительно легче, чем у бензола, и в более мягких условиях, благодаря наличию гидроксильного заместителя.
- Галогенирование
Особенно легко происходит бромирование в водных растворах. В отличие от бензола, для бромирование фенола не требуется добавление катализатора (FeBr 3 ). При взаимодействии фенола с бромной водой образуется белый осадок 2,4,6-трибромфенола:
- Нитрование также происходит легче, чем нитрование бензола. Реакция с разбавленной азотной кислотой идет при комнатной температуре. В результате образуется смесь орто- и параизомеров нитрофенола:
О-нитрофенол п-нитрофенол
При использовании концентрированной азотной кислоты образуется 2,4,6-тринитрофенол – пикриновая кислота, взрывчатое вещество:
Как вы видите фенол реагирует с бромной водой с образованием белого осадка, а вот бензол не реагирует. Фенол как и бензол реагирует с азотной кислотой, но не с одной молекулой а сразу с тремя. Чем это объясняется?
Приобретя избыток электронной плотности, бензольное кольцо дестабилизировалось. Отрицательный заряд сосредоточен в орто- и пара-положениях, поэтому эти положения наиболее активны. Замещение атомов водорода происходит именно здесь.
Фенол также как и бензол реагирует с серной кислотой, но с тремя молекулами.
- Сульфирование
Соотношение орто- и пара-измеров определяется температурой реакции: при комнатной температуре образуется в основном о-фенолсульфоксилота, при температуре 100 0 С – пара-изомер.
- Поликонденсация фенола с альдегидами, в част ности с формальдегидом, происходит с образовани ем продуктов реакции - фенолоформальдегидных смол и твердых полимеров (демонстрация ):
Реакция поликонденсации, т. е. реакция получения полимера, протекающая с выделением низкомолекулярного продукта (например, воды, аммиака и др.), может продолжаться и далее (до полного израсходования одного из реагентов) с образованием огромных макромолекул. Процесс можно описать суммарным уравнением:
Образование линейных молекул происходит при обычной температуре. Проведение же этой реакции при нагревании приводит к тому, что образующие имеет разветвленное строение, он твердый и нерастворимый в воде. В результате нагревания фенолоформальдегидной смолы линейного строения с избытком альдегида получаются твердые пластические массы с уникальными свойствами.
Полимеры на основе фенолоформальдегидных смол применяют для изготовления лаков и красок. Пластмассовые изделия, изготовленные на основе этих смол, устойчивы к нагреванию, охлаждению, действию щелочей и кислот, они также обладают высокими электрическими свойствами. Из полимеров на основе фенолоформальдегидных смол изготавливают наиболее важные детали электроприборов, корпуса силовых агрегатов и детали машин, полимерную основу печатных плат для радиоприборов.
Клеи на основе фенолоформальдегидных смол способны надежно соединять детали самой различной природы, сохраняя высочайшую прочность соединения в очень широком диапазоне температур. Такой клей применяется для крепления металлического цоколя ламп освещения в стеклянной колбе.
Все пластмассы с применением фенола опасны для человека и природы. Необходимо найти новый вид полимеров, безопасный для природы и легко разлагаемый в безопасные отходы. Это ваше будущее. Творите, изобретайте, не дайте опасным веществам погубить природу!”
Качественная реакция на фенолы
В водных растворах одноатомные фенолы взаимодействуют с FeCl 3 с образованием комплексных фенолятов, которые имеют фиолетовую окраску; окраска исчезает после прибавления сильной кислоты
Лабораторный опыт: 3. Реакция фенола с FeCl 3 .
В пробирку добавьте 1\3 часть раствора фенола и по каплям раствор FeCl 3 .
Оформите наблюдения.
Способы получения
- Кумольный способ.
В качестве исходного сырья используют бензол и пропилен, из которых получают изопропилбензол (кумол), подвергающийся дальнейшим превращениям.
Кумольный способ получения фенола (СССР, Сергеев П.Г., Удрис Р.Ю., Кружалов Б.Д., 1949 г.). Преимущества метода: безотходная технология (выход полезных продуктов > 99%) и экономичность. В настоящее время кумольный способ используется как основной в мировом производстве фенола.
- Из каменноугольной смолы.
Каменноугольную смолу, содержащую в качестве одно из компонентов фенол, обрабатывают вначале раствором щелочи (образуются феноляты), а затем кислотой:
C 6 H 5 OH + NaOH → C 6 H 5 ONa + H 2 O (фенолят натрия, промежуточный продукт)
C 6 H 5 ONa + H 2 SO 4 → C 6 H 5 OH + NaHSO 4
- Сплавление солей аренсульфокислот со щелочью:
300 0 C
С 6 Н 5 SO 3 Na + NaOH → C 6 H 5 OH + Na 2 SO 3
- Взаимодействие галогенопроизводных ароматических УВ со щелочами:
300 0 C, P, Cu
C 6 H 5 Cl + NaOH (8-10 % р-р) → C 6 H 5 OH + NaCl
или с водяным паром:
450-500 0 C, Al 2 O 3
C 6 H 5 Cl + H 2 O → C 6 H 5 OH + HCl
Биологическая роль соединений фенола
Положительная | Отрицательная (токсическое действие) |
|