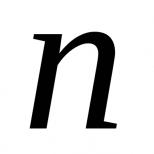Все про органические вещества. Органические соединения. Классы органических соединений. Какие классы органических веществ существуют
Первый подход – по природе углеводородного скелета
I. Ациклические или алифатические соединения - не содержат цикл:
предельные (насыщенные, парафиновые)
непредельные (ненасыщенные) с двойными, тройными связями.
II. Карбоциклические (в цикле только углерод) соединения:
алициклические – насыщенные и ненасыщенные циклические углеводороды;
ароматические – сопряженные циклические соединения с особыми ароматическими свойствами.
III. Гетероциклические соединения - в составе цикла гетероатомы (heteros – иной).
Второй подход – по природе функциональной группы, определяющей химические свойства соединения.
|
Функциональная группа |
Название |
||
|
Углеводороды |
|||
|
Ацетилен |
|||
|
Галогенсодержащие соединения |
|||
|
Галогенопроизводные |
–Hal (halogen) |
Хлористый этил, этилхлорид |
|
|
Кислородосодержащие соединения |
|||
|
Спирты, фенолы |
CH 3 CH 2 OH
|
Этиловый спирт, этанол |
|
|
Простые эфиры |
CH 3 –O–CH 3 |
Диметиловый эфир |
|
|
Альдегиды |
|
|
Уксусный альдегид, этаналь |
|
|
|
Ацетон, пропанон |
|
|
Карбоновые кислоты |
|
|
Уксусная кислота, этановая кислота |
|
Сложные эфиры |
|
|
Этиловый эфир уксусной кислоты, этилацетат |
|
Галогенангидриды |
|
|
Хлорангидрид уксусной кислоты, ацетилхлорид |
|
Ангидриды |
|
|
Ангидрид уксусной кислоты |
|
|
|
Амид уксусной кислоты, ацетамид |
|
|
Азотосодержащие соединения |
|||
|
Нитросоединения |
Нитрометан |
||
|
Этиламин |
|||
|
Ацетонитрил, нитрил уксусной кислоты |
|||
|
Нитрозосоединения |
Нитрозобензол |
||
|
Гидразосоединения |
Фенилгидразин |
||
|
Азосоединения |
C 6 H 5 N=NC 6 H 5 |
Азобензол |
|
|
Диазонивые соли |
Фенилдиазоний хлорид |
||
Номенклатура органических соединений
1) 1892 г. (Женева, Международный химический конгресс) - женевская ;
2) 1930 г. (Льеж, Международный союз теоретической и прикладной химии - International Union of Pure and Applied Chemistry (IUPAC) - льежская ;
Тривиальная номенклатура : названия дают случайно.
Хлороформ, мочевина.
Древесный спирт, винный спирт.
Муравьиная кислота, янтарная кислота.
Глюкоза, сахароза и т.д.
Рациональная номенклатура : в основе «рациональное звено» - название простейшего представителя класса + названия заместителей (начиная с простейшего) с указанием количества при помощи приставок ди-, три-, тетра-, пента- .
Встречается для простых органических соединений, особенно в старой химической литературе.

Положение заместителей указывают латинскими буквами
или словами “симметричный” (симм -), “несимметричный” (несимм -), орто -(о- ), мета - (м -), пара -(п -),
буквами N–(у азота), О–(у кислорода).

Номенклатура IUPAC (международная)
Основные принципы этой системы номенклатуры следующие.
1. В основе - самая длинная углеводородная цепь со старшей функциональной группой, обозначаемой суффиксом.
2. Атомы углерода в цепи нумеруются последовательно с того конца, к которому ближе расположена старшая функциональная группа.
При нумерации предпочтение (при прочих равных условиях) имеет двойная, затем тройная связь.
Если оба варианта нумерации равнозначны, то направление выбирается таким образом, чтобы сумма цифр, указывающих положение заместителей, была наименьшей (правильней – в которой первой стоит меньшая цифра).
3. К основе названия добавляются, начиная с простейшего, названия заместителей, при необходимости – с указанием их количества при помощи приставок ди-, три-, тетра-, пента-.
При этом для каждого заместителя указывают его номер в цепи.
Положение, название заместителей указывают в префиксе перед названием цепи, отделяя цифры дефисом.
Для функциональных групп цифра может стоять перед названием цепи или после названия цепи перед или после названия суффикса с отделением дефисом;
4. Названия заместителей (радикалов) могут быть системные и тривиальные.
Алкильные радикалы называют, изменяя окончание -ан на -ил в названии соответствующего алкана.
В названии радикала отражается тип атома углерода, имеющего свободную валентность: атом углерода, связанный
с одним углеродным атомом, называется первичным –СН 3 ,
с
двумя – вторичным
 ,
,
с
тремя – третичным

с
четырьмя – четвертичным
 .
.
Другие радикалы, имея или не имея окончание -ил , обычно носят тривиальное название.
Двухвалентные радикалы имеют окончание -ен или -иден.
|
Базовое соединение |
Название |
Структура радикала |
Название |
|
Одновалентные радикалы |
|||
|
CH 3 –CH 2 – | |||
|
CH 3 –CH 2 –CH 3 |
СH 3 –CH 2 –CH 2 – | ||
|
|
Изопропил (втор -пропил) |
||
|
CH 3 –CH 2 –CH 2 –CH 3 |
CH 3 –CH 2 –CH 2 –CH 2 – | ||
|
|
втор -Бутил |
||
|
|
Изобутан |
|
Изобутил |
|
|
трет -Бутил |
||
|
CH 3 (CH 2) 3 CH 3 |
CH 3 (CH 2) 3 CH 2 – |
(н -амил) |
|
|
|
Изопентан |
|
Изопентил (изоамил) |
|
|
Неопентан |
|
Неопентил |
|
|
| ||
|
CH 2 =CH–CH 2 – | |||
|
CH 3 –CH=CH– |
Пропенил |
||
|
Изначально называлась химия веществ, полученных из организмов растений и животных. С такими веществами человечество знакомо с глубокой древности. Люди умели получать уксус из прокисшего вина, а эфирные масла из растений, выделять сахар из сахарного тростника, извлекать природные красители из организмов растений и животных. Химики разделяли все вещества в зависимости от источника их получения на минеральные (неорганические), животные и растительные (органические). Долгое время считалось, что для получения органических веществ нужна особая «жизненная сила» - vis Vitalis, которая действует только в живых организмах, а химики способны всего лишь выделять органические вещества из продуктов. Шведский химик, президент Королевской шведской Академии наук. Научные исследования охватывают все главные проблемы общей химии первой половины XIX в. Экспериментально проверил и доказал достоверность законов постоянства состава и кратных отношений применительно к неорганическим оксидам и органическим соединениям. Определил атомную массу 45 химического элемента. Ввел современные обозначения химических элементов и первые формулы химических соединений. Шведский химик Й. Я. Берцелиус определил органическую химию как химию растительных или животных веществ, образующихся под влиянием «жизненной силы». Именно Берцелиус ввел понятия органические вещества и органическая химия. Развитие химии привело к накоплению большого количества фактов и к краху учения о «жизненной силе» - витализма. Немецкий ученый Ф. Вёлер в 1824 г. осуществил первый синтез органических веществ - получил щавелевую кислоту путем взаимодействия двух неорганических веществ - дициана и воды: N=- C-С=N + 4Н 2 0 -> СООН + 2NН 3 А в 1828 г. Вёлер, нагревая водный раствор неорганического вещества цианата аммония, получил мочевину - продукт жизнедеятельности животных организмов:
Изумленный таким результатом, Вёлер написал Берцелиусу: «Должен сказать Вам, что я умею приготовить мочевину, не нуждаясь ни в почке, ни в животном организме вообще...» Вёлер Фридрих (1800--1882} Немецкий химик. Иностранный член Петербургской Академии наук (с 1853 г.). Его исследования посвящены как неорганической, так и органической химии. Открыл циановую кислоту (1822), получил алюминий (1827), бериллий и иттрий (1828). В последующие годы блестяшие синтезы анилина Г. Кольбе и Э. Франклендом (1842), жира М. Бер^о (1854), сахаристых веществ А. Бутлеровым (1861) и др. окончательно похоронили миф о «жизненной силе». Появилось классическое определение К. Шорлеммера, не потерявшее своего значения и более 120 лет спустя: «Органическая химия есть химия углеводородов и их производных, т. е. продуктов, образующихся при замене водорода другими атомами или группами атомов». Сейчас органическую химию чаще всего называют химией соединений углерода. Почему же из более чем ста элементов Периодической системы Д. И. Менделеева природа именно углерод положила в основу всего живого? Ответ на этот вопрос неоднозначен. Многое вам станет понятно, когда вы рассмотрите строение атома углерода и поймете слова Д. И. Менделеева, сказанные им в «Основах химии» об этом замечательном элементе: «Углерод встречается в природе как в свободном, так и в соединительном состоянии, в весьма различных формах и видах... Способность атомов углерода соединяться между собой и давать сложные частицы проявляется во всех углеродистых соединениях... Ни в одном из элементов... способности к усложнению не развито в такой степени, как в углероде... Ни одна пара элементов не дает столь много соединений, как углерод с водородом». Многочисленные связи атомов углерода между собой и с атомами других элементов (водорода, кислорода, азота, серы, фосфора), входящих в состав органических веществ, могут разрушаться под влиянием природных факторов. Поэтому углерод совершает непрерывный круговорот в природе: из атмосферы (углекислый газ) - в растения (фотосинтез), из растений - в животные организмы, из живого - в мертвое, из мертвого - в живое... (рис. 1). Органические вещества имеют ряд особенностей, которые отличают их от неорганических веществ: 1. Неорганических веществ насчитывается немногим более 100 тыс., тогда как органических - почти 18 млн (табл. 1).
2. В состав всех органических веществ входят углерод и водород, поэтому большинство из них горючи и при горении обязательно образуют углекислый газ и воду. 3. Органические вещества построены более сложно, чем неорганические, и многие из них имеют огромную молекулярную массу, например те, благодаря которым происходят жизненные процессы: белки, жиры, углеводы, нуклеиновые кислоты и т. д. 4. Органические вещества можно расположить в ряды сходных по составу, строению и свойствам - гомологов. Гомологическим рядом называется ряд веществ, расположенных в порядке возрастания их относительных молекулярных масс, сходных по строению и химическим свойствам, где каждый член отличается от предыдущего на гомологическую разность СН 2 . Таблица 1. Рост числа известных органических соединений 5. Для органических веществ характерной является изомерия, очень редко встречающаяся среди неорганических веществ. Вспомните примеры изомеров, с которыми вы знакомились в 9 классе. В чем причина различий в свойствах изомеров? Изомерия - это явление существования разных веществ - изомеров с одинаковым качественным и количественным составом, т. е. одинаковой молекулярной формулой. Величайшим обобщением знаний о неорганических веществах является Периодический закон и Периодическая система элементов Д. И. Менделеева. Для органических веществ аналогом такого обобщения служит теория строения органических соединений А. М. Бутлерова . Вспомните, что Бутлеров понимал под химическим строением. Сформулируйте основные положения этой теории. Для количественной характеристики способности атомов одного химического элемента соединяться с определенным числом атомов другого химического элемента в неорганической химии, где большинство веществ имеет немолекулярное строение, применяют понятие «степень окисления>>. В органической химии, где большинство соединений имеет молекулярное строение, используют понятие «валентность». Вспомните, что означают эти понятия, сравните их. Велико значение органической химии в нашей жизни. В любом организме в любой момент протекает множество превращений одних органических веществ в другие. Поэтому без знаний органической химии невозможно понять, как осуществляется функционирование систем, образующих живой организм, т. е. сложно понимание биологии и медицины. С помощью органического синтеза получают разнообразные органические вещества: искусственные и синтетические волокна, каучуки, пластмассы, красители, пестициды (что это такое?), синтетические витамины, гормоны, лекарства и т. д. Многие современные продукты и материалы, без которых мы не можем обходиться, являются органическими веществами (табл. 2). Содержание урока конспект урока опорный каркас презентация урока акселеративные методы интерактивные технологии Практика задачи и упражнения самопроверка практикумы, тренинги, кейсы, квесты домашние задания дискуссионные вопросы риторические вопросы от учеников Иллюстрации аудио-, видеоклипы и мультимедиа фотографии, картинки графики, таблицы, схемы юмор, анекдоты, приколы, комиксы притчи, поговорки, кроссворды, цитаты Дополнения рефераты статьи фишки для любознательных шпаргалки учебники основные и дополнительные словарь терминов прочие Совершенствование учебников и уроков исправление ошибок в учебнике обновление фрагмента в учебнике элементы новаторства на уроке замена устаревших знаний новыми Только для учителей идеальные уроки календарный план на год методические рекомендации программы обсуждения Интегрированные урокиИзвестно, что свойства органических веществ определяются их составом и химическим строением. Поэтому неудивительно, что в основе классификации органических соединений лежит именно теория строения - теория Л. М. Бутлерова. Классифицируют органические вещества по наличию и порядку соединения атомов в их молекулах. Наиболее прочной и малоизменяемой частью молекулы органического вещества является ее скелет - цепь атомов углерода. В зависимости от порядка соединения атомов углерода в этой цепи вещества делятся на ациклические, не содержащие замкнутых цепей атомов углерода в молекулах, и карбоциклические, содержащие такие цени (циклы) в молекулах. Углеводороды - это соединения, состоящие только из атомов водорода и углерода. В зависимости от строения углеродной цепи органические соединения разделяют на соединения с открытой цепью - ациклические (алифатические) и циклические - с замкнутой цепью атомов. Циклические делятся на две группы: карбоциклические соединения (циклы образованы только атомами углерода) и гетероциклические (в циклы входят и другие атомы, такие как кислород, азот, сера). Карбоциклические соединения, в свою очередь, включают два ряда соединений: алицикличвские и ароматические. Ароматические соединения в основе строения молекул имеют плоские углеродсодержащие циклы с особой замкнутой системой р-электронов, образующих общую π-систему (единое π-электронное облако). Ароматичность характерна и для многих гетероциклических соединений. Все остальные карбоциклические соединения относятся к алициклическому ряду. Как ациклические (алифатические), так и циклические углеводороды могут содержать кратные (двойные или тройные) связи. Такие углеводороды называют непредельными (ненасыщенными) в отличие от предельных (насыщенных), содержащих только одинарные связи. Предельные алифатические углеводороды называют алканами , они имеют общую формулу С n Н 2 n +2 , где n - число атомов углерода. Старое их название часто употребляется и в настоящее время - парафины. Содержащие одну двойную связь , получили название алкены . Они имеют общую формулу С n Н 2 n . Непредельные алифатические углеводороды с двумя двойными связями называют алкадиенами Непредельные алифатические углеводороды с одной тройной связью называют алкинами . Их общая формула С n Н 2 n — 2 . Предельные алициклические углеводороды - циклоалканы , их общая формула С n Н 2 n . Особая группа углеводородов, ароматических , или аренов (с замкнутой общей π-электронной системой), известна из примера углеводородов с общей формулой С n Н 2 n -6. Таким образом, если в их молекулах один или большее число атомов водорода заменить на другие атомы или группы атомов (галогены, гидроксильные группы, аминогруппы и др.), образуются производные углеводородов : галогенопроизводные, кислородсодержащие, азотсодержащие и другие органические соединения. Галогенопроизводные углеводородов можно рассматривать как продукты замещения в углеводородах одного или нескольких атомов водорода атомами галогенов. В соответствии с этим могут существовать предельные и непредельные моно-, ди-, три- (в общем случае поли-) галогенопроизводные. Общая формула моногалогенопроизводных предельных углеводородов: а состав выражается формулой C n H 2 n +1 Г, где R - остаток от предельного углеводорода (алкана), углеводородный радикал (это обозначение используется и далее при рассмотрении других классов органических веществ), Г - атом галогена (F, Сl, Вг, I). Спирты - производные углеводородов, в которых один или несколько атомов водорода замещены на гидроксильные группы. Спирты называют одноатомными , если они имеют одну гидроксильную группу, и предельными, если они являются производными алканов. Общая формула предельных одноатомных спиртов: а их состав выражается общей формулой: Известны примеры многоатомных спиртов, т. е. имеющих несколько гндроксильных групп. Фенолы - производные ароматических углеводородов (ряда бензола), в которых один или несколько атомов водорода в бензольном кольце замещены на гидроксильные группы. Простейший представитель с формулой С 6 Н 5 ОН называется фенолом. Альдегиды и кетоны - производные углеводородов, содержащие карбонильную группу атомов (карбонил). В молекулах альдегидов одна связь карбонила идет на соединение с атомом водорода, другая - с углеводородным радикалом. В случае кетонов карбонильная группа связана с двумя (в общем случае разными) радикалами. Состав предельных альдегидов и кетонов выражается формулой С n Н 2л О. Карбоновые кислоты - производные углеводородов, содержащие карбоксильные группы (-СООН). Если в молекуле кислоты одна карбоксильная группа, то карбоновая кислота является одноосновной. Общая формула предельных одноосновных кислот (R-СООН). Их состав выражается формулой С n Н 2 n O 2 . Простые эфиры представляют собой органические вещества, содержащие два углеводородных радикала, соединенных атомом кислорода: R-О-R или R 1 -O-R 2 . Радикалы могут быть одинаковыми или разными. Состав простых эфиров выражается формулой С n Н 2 n +2 O Сложные эфиры - соединения, образованные замещением атома водорода карбоксильной группы в карбоновых кислотах на углеводородный радикал. Нитросоединения - производные углеводородов, в которых один или несколько атомов водорода замещены на нитрогруппу -NO 2 . Общая формула предельных мононитросоединений: а состав выражается общей формулой С n Н 2 n +1 NO 2 . Амины - соединения, которые рассматривают как производные аммиака (NН 3), в котором атомы водорода замещены на углеводородные радикалы. В зависимости от природы радикала амины могут быть алифатическими и ароматическими . В зависимости от числа замещенных на радикалы атомов водорода различают: Первичные амины с общей формулой: R-NН 2 Вторичные - с общей формулой: R 1 -NН-R 2 Третичные - с общей формулой: В частном случае у вторичных, а также третичных аминов радикалы могут быть и одинаковыми. Первичные амины можно также рассматривать как производные углеводородов (алканов), в которых один атом водорода замещен на аминогруппу -NН 2 . Состав предельных первичных аминов выражается формулой С n Н 2 n +3 N. Аминокислоты содержат две функциональные группы, соединенные с углеводородным радикалом: аминогруппу -NН 2 , и карбоксил -СООН. Состав предельных аминокислот, содержащих одну аминогруппу и один карбоксил, выражается формулой С n Н 2 n +1 NO 2 . Известны и другие важные органические соединения, которые имеют несколько разных или одинаковых функциональных групп, длинные линейные цепи, связанные с бензольными кольцами. В таких случаях строгое определение принадлежности вещества к какому-то определенному классу невозможно. Эти соединения часто выделяют в специфические группы веществ: углеводы, белки, нуклеиновые кислоты, антибиотики, алкалоиды и др.
Для названия органических соединений используют 2 номенклатуры — рациональную и систематическую (ИЮПАК) и тривиальные названия. Составление названий по номенклатуре ИЮПАК 1) Основу названия соединения составляет корень слова, обозначающий предельный углеводород с тем же числом атомов, что и главная цепь. 2) К корню добавляют суффикс, характеризующий степень насыщенности: Ан (предельный, нет кратных связей); Если кратных связей несколько, то в суффиксе указывается число таких связей (-диен, -триен и т.д.), а после суффикса обязательно указывается цифрами положение кратной связи, например: СН 2 =СН–СН=СН 2 Такие группы как нитро-, галогены, углеводородные радикалы, не входящие в главную цепь выносятся в приставку. При этом они перечисляются по алфавиту. Положение заместителя указывается цифрой перед приставкой. Порядок составления названия следующий: 1. Найти самую длинную цепь атомов С. 2. Последовательно пронумеровать атомы углерода главной цепи, начиная с ближайшего к разветвлению конца. 3. Название алкана складывается из названий боковых радикалов, перечисленных в алфавитном порядке с указанием положения в главной цепи, и названия главной цепи. Номенклатура некоторых органических веществ (тривиальная и международная)
Классификация органических веществ еще более сложна. Это обусловлено целым рядом причин: чрезвычайной многочисленностью органических соединений, сложностью и разнообразием их строения, самой историей изучения соединений углерода. Действительно, до середины XIX в. органическая химия, по образному выражению Ф.Велера*, представлялась «дремучим лесом, полным удивительных вещей, безграничной чащей, из которой нельзя выбраться, куда не осмеливаешься проникнуть». Только с появлением в 1861 г. теории химического строения органических соединений «дремучий лес» органической химии стал преобразовываться в залитый солнечным светом регулярный парк со строгой сеткой аллей и дорожек. Авторами этой теории явилось выдающееся интернациональное трио ученых-химиков: наш соотечественник А.М.Бутлеров**, немец Ф.А.Кекуле и англичанин А.Купер. Рис. 5. Фридрих Велер
Рис. 6. Александр Сущность созданной ими теории химического строения можно сформулировать в виде трех положений. Сегодня кажется невероятным, что до середины XIX в., в период великих открытий в естествознании, ученые плохо представляли себе внутреннее устройство вещества. Именно Бутлеров ввел термин «химическое строение», подразумевая под ним систему химических связей между атомами в молекуле, их взаимное расположение в пространстве. Благодаря такому пониманию строения молекулы оказалось возможным объяснить явление изомерии, предсказать существование неизвестных изомеров, соотнести свойства веществ с их химическим строением. В качестве иллюстрации явления изомерии приведем формулы и свойства двух веществ – этилового спирта и диметилового эфира, имеющих одинаковый элементный состав С2Н6О, но различное химическое строение (табл. 2).
Явление изомерии, очень широко распространенное в органической химии, является одной из причин многообразия органических веществ. Другая причина многообразия органических веществ заключается в уникальной способности атома углерода образовывать друг с другом химические связи, в результате чего получаются углеродные цепи
Если учесть, что между двумя атомами углерода могут существовать не только простые (одинарные) связи С–С, но также двойные С=С и тройные С≡С, то число вариантов углеродных цепей и, следовательно, различных органических веществ значительно увеличивается.
Наличие в молекуле углеводорода одной двойной связи позволяет отнести его к классу алкенов, причем его отношение к этой группе веществ подчеркивается
Как вы уже поняли, помимо углерода и водорода, в состав органических веществ могут входить атомы других элементов, в первую очередь кислорода и азота. Чаще всего атомы этих элементов в различных сочетаниях образуют группы, которые называют функциональными.
Функциональная группа –ОН называется гидроксильной и определяет принадлежность к одному из важнейших классов органических веществ – спиртам.
В прошлом ученые разделяли все вещества в природе на условно неживые и живые, включая в число последних царство животных и растений. Вещества первой группы получили название минеральных. А те, что вошли во вторую, стали называть органическими веществами. Что под этим подразумевается? Класс органических веществ наиболее обширный среди всех химических соединений, известных современным ученым. На вопрос, какие вещества органические, можно ответить так – это химические соединения, в состав которых входит углерод. Обратите внимание, что не все углеродсодержащие соединения относятся к органическим. Например, корбиды и карбонаты, угольная кислота и цианиды, оксиды углерода не входят в их число. Почему органических веществ так много?Ответ на этот вопрос кроется в свойствах углерода. Этот элемент любопытен тем, что способен образовывать цепочки из своих атомов. И при этом углеродная связь очень стабильная. Кроме того, в органических соединениях он проявляет высокую валентность (IV), т.е. способность образовывать химические связи с другими веществами. И не только одинарные, но также двойные и даже тройные (иначе – кратные). По мере возрастания кратности связи цепочка атомов становится короче, а стабильность связи повышается. А еще углерод наделен способностью образовывать линейные, плоские и объемные структуры. Именно поэтому органические вещества в природе так разнообразны. Вы легко проверите это сами: встаньте перед зеркалом и внимательно посмотрите на свое отражение. Каждый из нас – ходячее пособие по органической химии. Вдумайтесь: не меньше 30% массы каждой вашей клетки – это органические соединения. Белки, которые построили ваше тело. Углеводы, которые служат «топливом» и источником энергии. Жиры, которые хранят запасы энергии. Гормоны, которые управляют работой органов и даже вашим поведением. Ферменты, запускающие химические реакции внутри вас. И даже «исходный код», цепочки ДНК – все это органические соединения на основе углерода. Состав органических веществКак мы уже говорили в самом начале, основной строительный материал для органических веществ – это углерод. И практические любые элементы, соединяясь с углеродом, могут образовывать органические соединения. В природе чаще всего в составе органических веществ присутствуют водород, кислород, азот, сера и фосфор. Строение органических веществМногообразие органических веществ на планете и разнообразие их строения можно объяснить характерными особенностями атомов углерода. Вы помните, что атомы углерода способны образовывать очень прочные связи друг с другом, соединяясь в цепочки. В результате получаются устойчивые молекулы. То, как именно атомы углерода соединяются в цепь (располагаются зигзагом), является одной из ключевых особенностей ее строения. Углерод может объединяться как в открытые цепи, так и в замкнутые (циклические) цепочки. Важно и то, что строение химических веществ прямо влияет на их химические свойства. Значительную роль играет и то, как атомы и группы атомов в молекуле влияют друг на друга. Благодаря особенностям строения, счет однотипным соединениям углерода идет на десятки и сотни. Для примера можно рассмотреть водородные соединения углерода: метан, этан, пропан, бутан и т.п. Например, метан – СН 4 . Такое соединение водорода с углеродом в нормальных условиях пребывает в газообразном агрегатном состоянии. Когда же в составе появляется кислород, образуется жидкость – метиловый спирт СН 3 ОН. Не только вещества с разным качественным составом (как в примере выше) проявляют разные свойства, но и вещества одинакового качественного состава тоже на такое способны. Примером могут служить различная способность метана СН 4 и этилена С 2 Н 4 реагировать с бромом и хлором. Метан способен на такие реакции только при нагревании или под ультрафиолетом. А этилен реагирует даже без освещения и нагревания. Рассмотрим и такой вариант: качественный состав химических соединений одинаков, количественный – отличается. Тогда и химические свойства соединений различны. Как в случае с ацетиленом С 2 Н 2 и бензолом С 6 Н 6 . Не последнюю роль в этом многообразии играют такие свойства органических веществ, «завязанные» на их строении, как изомерия и гомология. Представьте, что у вас есть два на первый взгляд идентичных вещества – одинаковый состав и одна и та же молекулярная формула, чтобы описать их. Но строение этих веществ принципиально различно, откуда вытекает и различие химических и физических свойств. К примеру, молекулярной формулой С 4 Н 10 можно записать два различных вещества: бутан и изобутан.
Речь идет об изомерах – соединениях, которые имеют одинаковый состав и молекулярную массу. Но атомы в их молекулах расположены в различном порядке (разветвленное и неразветвленное строение). Что касается гомологии – это характеристика такой углеродной цепи, в которой каждый следующий член может быть получен прибавлением к предыдущему одной группы СН 2 . Каждый гомологический ряд можно выразить одной общей формулой. А зная формулу, несложно определить состав любого из членов ряда. Например, гомологи метана описываются формулой C n H 2n+2 . По мере прибавления «гомологической разницы» СН 2 , усиливается связь между атомами вещества. Возьмем гомологический ряд метана: четыре первых его члена – газы (метан, этан, пропан, бутан), следующие шесть – жидкости (пентан, гексан, гептан, октан, нонан, декан), а дальше следуют вещества в твердом агрегатном состоянии (пентадекан, эйкозан и т.д.). И чем прочнее связь между атомами углерода, тем выше молекулярный вес, температуры кипения и плавления веществ. Какие классы органических веществ существуют?К органическим веществам биологического происхождения относятся:
Три первых пункта можно еще назвать биологическими полимерами. Более подробная классификация органических химических веществ охватывает вещества не только биологического происхождения. К углеводородам относятся:
Есть также иные классы органических соединений, в составе которых углерод соединяется с другими веществами, кроме водорода:
Формулы органических веществ по классам Примеры органических веществКак вы помните, в человеческом организме различного рода органические вещества – основа основ. Это наши ткани и жидкости, гормоны и пигменты, ферменты и АТФ, а также многое другое. В телах людей и животных приоритет за белками и жирами (половина сухой массы клетки животных это белки). У растений (примерно 80% сухой массы клетки) – за углеводами, в первую очередь сложными – полисахаридами. В том числе за целлюлозой (без которой не было бы бумаги), крахмалом. Давайте поговорим про некоторые из них подробнее. Например, про углеводы . Если бы можно было взять и измерить массы всех органических веществ на планете, именно углеводы победили бы в этом соревновании. Они служат в организме источником энергии, являются строительными материалами для клеток, а также осуществляют запас веществ. Растениям для этой цели служит крахмал, животным – гликоген. Кроме того, углеводы очень разнообразны. Например, простые углеводы. Самые распространенные в природе моносахариды – это пентозы (в том числе входящая в состав ДНК дезоксирибоза) и гексозы (хорошо знакомая вам глюкоза). Как из кирпичиков, на большой стройке природы выстраиваются из тысяч и тысяч моносахаридов полисахариды. Без них, точнее, без целлюлозы, крахмала, не было бы растений. Да и животным без гликогена, лактозы и хитина пришлось бы трудно. Посмотрим внимательно и на белки . Природа самый великий мастер мозаик и пазлов: всего из 20 аминокислот в человеческом организме образуется 5 миллионов типов белков. На белках тоже лежит немало жизненно важных функций. Например, строительство, регуляция процессов в организме, свертывание крови (для этого существуют отдельные белки), движение, транспорт некоторых веществ в организме, они также являются источником энергии, в виде ферментов выступают катализатором реакций, обеспечивают защиту. В деле защиты организма от негативных внешних воздействий важную роль играют антитела. И если в тонкой настройке организма происходит разлад, антитела вместо уничтожения внешних врагов могут выступать агрессорами к собственным органам и тканям организма.
Белки также делятся на простые (протеины) и сложные (протеиды). И обладают присущими только им свойствами: денатурацией (разрушением, которое вы не раз замечали, когда варили яйцо вкрутую) и ренатурацией (это свойство нашло широкое применение в изготовлении антибиотиков, пищевых концентратов и др.). Не обойдем вниманием и липиды (жиры). В нашем организме они служат запасным источником энергии. В качестве растворителей помогают протеканию биохимических реакций. Участвуют в строительстве организма – например, в формировании клеточных мембран. И еще пару слов о таких любопытных органических соединениях, как гормоны . Они участвуют в биохимических реакциях и обмене веществ. Такие маленькие, гормоны делают мужчин мужчинами (тестостерон) и женщин женщинами (эстроген). Заставляют нас радоваться или печалиться (не последнюю роль в перепадах настроения играют гормоны щитовидной железы, а эндорфин дарит ощущение счастья). И даже определяют, «совы» мы или «жаворонки». Готовы вы учиться допоздна или предпочитаете встать пораньше и сделать домашнюю работу перед школой, решает не только ваш распорядок дня, но и некоторые гормоны надпочечников. ЗаключениеМир органических веществ по-настоящему удивительный. Достаточно углубиться в его изучение лишь немного, чтобы у вас захватило дух от ощущения родства со всем живым на Земле. Две ноги, четыре или корни вместо ног – всех нас объединяет волшебство химической лаборатории матушки-природы. Оно заставляет атомы углерода объединяться в цепочки, вступать в реакции и создавать тысячи таких разнообразных химических соединений. Теперь у вас есть краткий путеводитель по органической химии. Конечно, здесь представлена далеко не вся возможная информация. Какие-то моменты вам, быть может, придется уточнить самостоятельно. Но вы всегда можете использовать намеченный нами маршрут для своих самостоятельных изысканий. Вы также можете использовать приведенное в статье определение органического вещества, классификацию и общие формулы органических соединений и общие сведения о них, чтобы подготовиться к урокам химии в школе. Расскажите нам в комментариях, какой раздел химии (органическая или неорганическая) нравится вам больше и почему. Не забудьте «расшарить» статью в социальных сетях, чтобы ваши одноклассники тоже смогли ею воспользоваться. Пожалуйста, сообщите, если обнаружите в статье какую-то неточность или ошибку. Все мы люди и все мы иногда ошибаемся. сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна. | |||