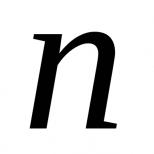Механизм образования коллоидной частицы. Коллоидные растворы (золи) Методы получения
Обратимся к другому явлению, когда местоположение зарядов определяется потенциалом, создаваемым в какой-то степени самими зарядами. Такой эффект существен для поведения коллоидов. Коллоид - это взвесь маленьких заряженных частичек в воде. Хотя эти частички и микроскопические, но по сравнению с атомом они все же очень велики. Если бы коллоидные частицы не были заряжены, они бы стремились коагулировать (слиться) в большие комки; но, будучи заряженными, они отталкиваются друг от друга и остаются во взвешенном состоянии. Если в воде растворена еще соль, то она диссоциирует (расползается) на положительные и отрицательные ионы. (Такой раствор ионов называется электролитом.) Отрицательные ионы притягиваются к коллоидным частицам (будем считать, что их заряды положительны), а положительные - отталкиваются. Нам нужно узнать, как ионы, окружающие каждую частицу коллоида, распределены в пространстве.
Чтобы мысль была яснее, рассмотрим только одномерный случай. Представим себе коллоидную частицу в виде очень большого (по сравнению с атомом!) шара; тогда мы можем малую часть ее поверхности считать плоскостью. (Вообще, пытаясь понять новое явление, лучше разобраться в нем на чрезвычайно упрощенной модели; и только потом, поняв суть проблемы, стоит браться за более точные расчеты.)
Предположим, что распределение ионов создает плотность зарядов и электрический потенциал , связанные электростатическим законом , или в одномерном случае законом
Как бы распределились ионы в таком поле, если бы потенциал подчинялся этому уравнению? Узнать это можно при помощи принципов статистической механики. Вопрос в том, как определить , чтобы вытекающая из статистической механики плотность заряда тоже удовлетворяла бы условию (7.28)?
Согласно статистической механике (см. вып. 4, гл. 40), частицы, пребывая в тепловом равновесии в поле сил, распределяются так, что плотность частиц с координатой дается формулой
![]() , (7.29)
, (7.29)
где - потенциальная энергия, - постоянная Больцмана, а - абсолютная температура.
Предположим, что у всех ионов один и тот же электрический заряд, положительный или отрицательный. На расстоянии от поверхности коллоидной частицы положительный ион будет обладать потенциальной энергией
![]()
Плотность положительных ионов тогда равна
![]() ,
,
а плотность отрицательных
![]()
Суммарная плотность заряда
![]() ,
,
![]() (7.30)
(7.30)
Подставляя в (7.28), увидим, что потенциал должен удовлетворять уравнению
![]() (7.31)
(7.31)
Это уравнение решается в общем виде [помножьте обе его части на и проинтегрируйте по ], но, продолжая упрощать задачу, мы ограничимся здесь только предельным случаем малых потенциалов или высоких температур . Малость отвечает разбавленному раствору. Показатель экспоненты тогда мал, и можно взять
![]() (7.32)
(7.32)
Уравнение (7.31) дает
![]() (7.33)
(7.33)
Заметьте, что теперь в правой части стоит знак плюс (решение не колебательное, а экспоненциальное).
Общее решение (7.33) имеет вид
![]() , (7.34)
, (7.34)
Постоянные и определяются из добавочных условий. В нашем случае должно быть нулем, иначе потенциал для больших обратится в бесконечность. Итак,
где - потенциал при на поверхности коллоидной частицы.
Потенциал убывает в раз при удалении на (фиг. 7.7). Число называется дебаевской длиной; это мера толщины ионной оболочки, окружающей в электролите каждую большую заряженную частицу. Уравнение (7.36) утверждает, что оболочка становится тоньше по мере увеличения концентрации ионов или уменьшения температуры.

Фигура 7.7. Изменение потенциала у поверхности коллоидной частицы. - дебаевская длина.
Постоянную в (7.36) легко получить, если известен поверхностный заряд а на поверхности заряженной частицы. Мы знаем, что
![]() (7.37)
(7.37)
Мы сказали, что коллоидные частицы не слипаются вследствие электрического отталкивания. Но теперь мы видим, что невдалеке от поверхности частицы из-за возникающей вокруг нее ионной оболочки поле спадает. Если бы оболочка стала достаточно тонкой, у частиц появился бы шанс столкнуться друг с другом. Тогда они бы слиплись, коллоид бы осадился и выпал из жидкости. Из нашего анализа ясно, что после добавления в коллоид подходящего количества соли начнется выпадение осадка. Этот процесс называется «высаливанием коллоида».
Другой интересный пример - это влияние растворения соли на осаждение белка. Молекула белка - это длинная, сложная и гибкая цепь аминокислот. На ней там и сям имеются заряды, и временами заряд какого-то одного знака, скажем отрицательного, распределяется вдоль всей цепи. В результате взаимного отталкивания отрицательных зарядов белковая цепь распрямляется. Если в растворе имеются еще другие такие же молекулы-цепочки, то они не слипаются между собой вследствие того же отталкивания. Так возникает в жидкости взвесь молекул-цепочек. Но стоит добавить туда соли, как свойства взвеси изменятся. Уменьшится дебаевская длина, молекулы начнут сближаться и свертываться в спирали. А если соли много, то молекулы белка начнут выпадать в осадок. Существует множество других химических явлений, которые можно понять на основе анализа электрических сил.
Коллоидные растворы - это высокодисперсные двухфазные системы, состоящие из дисперсионной среды и дисперсной фазы, причем линейные размеры частиц последней лежат в пределах от 10 -9 м до 10 -7 м. Как видно, коллоидные растворы по размерам частиц являются промежуточными между истинными растворами и суспензиями и эмульсиями. Коллоидные частицы обычно состоят из большого числа молекул или ионов.
Коллоидные растворы иначе называют золями. Их получают дисперсионными и конденсационными методами. Диспергирование чаще всего производят при помощи особых “коллоидных мельниц”. При конденсационном методе коллоидные частицы образуются за счет объединения атомов или молекул в агрегаты. Так, если возбудить в воде дуговой электрический разряд между двумя проволоками из серебра, то пары металла конденсируются в коллоидные частицы. При протекании многих химических реакций также происходит конденсация и образуются высокодисперсные системы (выпадение осадков, протекание гидролиза, окислительно-восстановительные реакции и т.д.).
Золи обладают рядом специфических свойств, которые подробно изучает коллоидная химия. Золи в зависимости от размеров частиц могут иметь различную окраску, а у истинных растворов она одинаковая. Например, золи золота могут быть синими, фиолетовыми, вишневыми, рубиново-красными.
В отличие от истинных растворов для золей характерен эффект Тиндаля, т. е. рассеяние света коллоидными частицами. При пропускании через золь пучка света появляется светлый конус, видимый в затемненном помещении. Так можно распознать, является данный раствор коллоидным или истинным. Строение структурной единицы лиофобных коллоидов – мицеллы – может быть показано лишь схематически, поскольку мицелла не имеет определенного состава. Рассмотрим строение коллоидной мицеллы на примере гидрозоля иодида серебра, получаемого взаимодействием разбавленных растворов нитрата серебра и иодида калия:
AgNO 3 + KI ––> AgI + KNO 3
Коллоидная мицелла золя иодида серебра (см. рис. 4.9) образована микрокристаллом иодида серебра, который способен к избирательной адсорбции из окружающей среды катионов Ag+ или иодид-ионов. Если реакция проводится в избытке иодида калия, то ядро будет адсорбировать иодид-ионы; при избытке нитрата серебра микрокристалл адсорбирует ионы Ag+. В результате этого микрокристалл приобретает отрицательный либо положительный заряд; ионы, сообщающие ему этот заряд, называются потенциалопределяющими , а сам заряженный кристалл – ядром мицеллы . Заряженное ядро притягивает из раствора ионы с противоположным зарядом – противоионы ; на поверхности раздела фаз образуется двойной электрический слой. Некоторая часть противоионов адсорбируется на поверхности ядра, образуя т.н. адсорбционный слой противоионов ; ядро вместе с адсорбированными на нем противоионами называют коллоидной частицей или гранулой. Остальные противоионы, число которых определяется, исходя из правила электронейтральности мицеллы, составляют диффузный слой противоионов ; противоионы адсорбционного и диффузного слоев находятся в состоянии динамического равновесия адсорбции – десорбции.
Схематически мицелла золя иодида серебра, полученного в избытке иодида калия (потенциалопределяющие ионы – анионы I – , противоионы – ионы К +) может быть изображена следующим образом:
{ m · nI – · (n-x)K + } x– · x K +
При получении золя иодида серебра в избытке нитрата серебра коллоидные частицы будут иметь положительный заряд:
{ m · nAg + · (n-x)NO 3 – } x+ · x NO 3 –
Рис.1 Строение коллоидной мицеллы
Агрегативная устойчивость золей обусловлена, таким образом, рядом факторов: во-первых, снижением поверхностной энергии дисперсной фазы (т.е. уменьшения движущей силы коагуляции) в результате образования двойного электрического слоя и, во-вторых, наличием кинетических препятствий для коагуляции в виде электростатического отталкивания имеющих одноименный заряд коллоидных частиц и противоионов. Еще одна причина устойчивости коллоидов связана с процессом гидратации (сольватации) ионов. Противоионы диффузного слоя сольватированы; эта оболочка из сольватированных противоионов также препятствует слипанию частиц.
Одним из важных свойств золей является то, что их частицы имеют электрические заряды одного знака. Благодаря этому они не соединяются в более крупные частицы и не осаждаются. При этом частицы одних золей, например металлов, сульфидов, кремниевой и оловянной кислот, имеют отрицательный заряд, других, например гидроксидов, оксидов металлов, - положительный заряд. Возникновение заряда объясняется адсорбцией коллоидными частицами ионов из раствора.
Для осаждения золя необходимо, чтобы его частицы соединились в более крупные агрегаты. Соединение частиц в более крупные агрегаты называется коагуляцией, а осаждение их под влиянием силы тяжести - седиментацией.
Обычно коагуляция происходит при прибавлении к золю: 1) электролита, 2) другого золя, частицы которого имеют противоположный заряд, и 3) при нагревании.
При определенных условиях коагуляция золей приводит к образованию студенистой массы, называемой гелем. В этом случае вся масса коллоидных частиц, связывая растворитель, переходит в своеобразное полужидкое-полутвердое состояние. От гелей следует отличать студни - растворы высокомолекулярных веществ в низкомолекулярных жидкостях (системы гомогенные). Их можно получить при набухании твердых полимеров в определенных жидкостях.
Значение золей исключительно велико, так как они более распространены, чем истинные растворы. Протоплазма живых клеток, кровь, соки растений - все это сложные золи. С золями связано получение искусственных волокон, дубление кож, крашение, изготовление клеев, лаков, пленок, чернил. Много золей в почве, и они имеют первостепенное значение для ее плодородия.
1 . Золь фторида кальция получен смешиванием 32 мл раствора фторида натрия с молярной концентрацией NaF, равной 8,0·10 -3 моль/л и 25 мл раствора хлорида кальция с молярной концентрацией CaCl 2 , равной 9,6·10 -3 моль/л. Напишите формулу мицеллы полученного золя, укажите все её составные части. Определите тип коллоида, знак заряда гранулы коллоидной частицы золя и направление её движения в электрическом поле.
Решение . Зная молярные концентрации растворов NaF и CaCl 2 , определяем количество вещества фторида натрия ν(NaF) и хлорида кальция ν(СаСl 2), вступивших в реакцию обмена по уравнению
2NaF + CaCl 2 = ↓CaF 2 + 2NaCl:
ν(NaF) = Cμ(NaF)·V(NaF) = (8,0·10 -3 моль/л)·(32·10 -3 л) = 2,56·10 -4 моль,
ν(CaCl 2) = Cμ(CaCl 2)·V(CaCl 2) = (9,6·10 -3 моль/л)·(25·10 -3 л) = 2,4·10 -4 моль.
Cогласно уравнению реакции, вещества взаимодействуют между собой в соотношении ν(NaF):ν(CaCl 2) = 2:1, а из приведенных расчетов видно, что ν(NaF):ν(CaCl 2) =(2,56·10 -4)/(2,4·10 -4) = 1,07:1, т.е. в растворе имеется избыток хлорида кальция, который и служит в данном случае стабилизатором коллоидной мицеллы. Поскольку по условию задачи речь идет о водных растворах взаимодействующих солей, то ионы стабилизатора (Са + и Cl -) будут гидратированными, т.е. окруженными молекулами растворителя Н 2 О. Вместе с тем, зародыш коллоидной частицы, формирующийся из нерастворимых молекул фторида кальция СаF 2 , будучи веществом кристаллическим, воду не поглощает. Отсюда первый вывод – коллоридная частица является гидрофобной .
Из ионов стабилизатора генетически близким к составу зародыша (согласно правилу Пескова-Фаянса) является ион кальция Са 2+ . Отсюда мы делаем второй вывод – потенциалопределяющими ионами будут ионы Са 2+ ·ρН 2 О , и, следовательно, гранула коллоидной мицеллы будет положительно заряженной , т.е. в электрическом поле будет перемещаться к катоду .
Противоионами в этом растворе служат гидратированные хлорид-ионы стабилизатора 2Cl - ·(q+ℓ)H 2 O , которые располагаются вокруг ядра двумя слоями : первый – адсорбционный, состоящий из 2Cl - ·qH 2 O, второй – диффузный, его строение 2Cl - ·ℓH 2 O.
Теперь можно записать мицеллярную формулу частицы золя фторида кальция:
{[(m(CaF 2)·nCa 2+ ·ρН 2 О) 2 n+ ·2(n-x)Cl - ·qH 2 O] 2 x+ + 2xCl - ·ℓH 2 O} 0 .
потенциал- |зародыш _| адсорбц. слой диффузн. слой
определяющий | ядро | противоионов
ион | гранула |
| мицелла |
Как видим, гранула золя CaF 2 в данном случае заряжена положительно и при наложении электрического поля гранула будет двигаться к отрицательно заряженному электроду (катоду), а противоионы диффузного слоя (2хCl - ·ℓH 2 O) – к положительно заряженному электроду (аноду).
Ответ : образуется гидрофобный золь, гранула заряжена положительно, перемещается под дейситвием электрического поля к катоду.
2 . Золь сульфата бария получен смешением равных объемов растворов нитрата бария и серной кислоты. Напишите формулу мицеллы золя, гранула которой в электрическом поле перемещается к аноду. Ответьте на вопрос, будут ли одинаковыми исходные молярные концентрации электролитов. Укажите природу и строение мицеллы золя.
Решение . Нерастворимой дисперсной фазой в коллоидном растворе, образующемся при смешивании растворов Ba(NO 3) 2 и H 2 SO 4 , будет кристаллический сульфат бария, согласно реакции обмена
Ba(NO 3) 2 + H 2 SO 4 = ↓BaSO 4 + 2HNO 3 .
Поскольку дисперсная фаза имеет кристаллическую структуру, то образующаяся на её основе мицелла является гидрофобной. Если гранула перемещается к аноду, значит, она имеет отрицательный заряд и, следовательно, потенциалопределяющими ионами могут быть только гидратированные анионы SO 4 2- ·рН 2 О (правило Пескова-Фаянса). Ясно, что противоионами выступают гидратированные протоны 2Н + ·(q+ℓ)H 2 O, т.е. электролитом-стабилизатором является серная кислота, а значит, её концентрация в этой системе должна быть больше в сравнении с концентрацией раствора нитрата бария:С μ (H 2 SO 4) > С μ (Ba(NO 3) 2 .
С учетом проведенного анализа, построим формулу мицеллы гидрофобного золя сульфата бария:
![]() {[(m(BaSO 4)· nSO 4 2- ·рН 2 О) 2 n- ·2(n-x)H + ·qH 2 O] 2 x- + 2xH + ·ℓH 2 O} 0 .
{[(m(BaSO 4)· nSO 4 2- ·рН 2 О) 2 n- ·2(n-x)H + ·qH 2 O] 2 x- + 2xH + ·ℓH 2 O} 0 .
Потенциал- | зародыш | адсорбц. слой диффузн. слой
определяющий | ядро | противоионов
ион | гранула |
| мицелла |
Ответ : золь сульфата бария гидрофобный, гранула заряжена отрицательно, в раствореС μ (H 2 SO 4) > С μ (Ba(NO 3) 2 .
3 . Золь гидроксида железа (3), полученный при добавлении к 85 мл кипящей дистиллированной воды 15 мл раствора хлорида железа (3) с массовой долей FeCl 3 , равной 2%, образуется в результате частичного гидролиза соли по уравнению:
FeCl 3 + 3H 2 O = ↓Fe(OH) 3 + 3HCl.
Напишите возможные формулы мицелл золя Fe(OH) 3 , учитывая, что при образовании частиц гидроксида железа (3) в растворе присутствовали следующие ионы: Fe 3+ , FeO + , H + , Cl - , ОН - . При этом все ионы гидратированы молекулами растворителя.
Решение . Как показывает уравнение гидролиза, приведенное в условии задачи, образованию нерастворимого гидроксида железа (3) соответствует соотношение Сμ(Fe 3+):Сμ(ОН -) = ν(Fe 3+):ν(ОН -) = 1:3.
Определим количество вещества каждого из участников процесса гидролиза. Согласно данным таблицы №3 приложения № 10, плотность 2% раствора хлорида железа (3) при нормальных условиях равна 1,015 г/см 3 . Зависимость массы FeCl 3 и массовой доли ω(FeCl 3) определяется из соотношения m(FeCl 3) = ω(FeCl 3)·V р-ра (FeCl 3)·ρ р-ра (FeCl 3). С другой стороны, количество вещества соли ν(FeCl 3) = m(FeCl 3)/M(FeCl 3), где M(FeCl 3) – молярная масса хлорида железа, она равна M(FeCl 3) = 56 + 3·35,5 = 162,5 г/моль. Отсюда получаем расчетную формулу для определения количества вещества соли, а значит, и количества вещества ионов Fe 3+ , вступивших в реакцию гидролиза:
ν(Fe 3+) = ν(FeCl 3) = [ω(FeCl 3)·V р-ра (FeCl 3)·ρ р-ра (FeCl 3)]/M(FeCl 3).
Произведем соответствующие расчеты и получим:
ν(Fe 3+) = ν(FeCl 3) = (0,02·15·1,015)/162,5 = 1,85·10 -3 моль.
Для определения концентрации Сμ и количества вещества ν гидроксид-ионов ОН – вспомним правило ионного произведения воды. Оно гласит, что в нейтральном растворе молярные концентрации ионов Н + и ОН – равны и не превышают 1·10 -7 моль/л. При гидролизе, как показывает уравнение в условии задачи, концентрация ОН – будет и того меньше (гидролиз приводит к подкислению раствора). Даже если мы допустим, что в нашей системе присутствует 100 мл чистой воды, то в них будет содержаться не более 1·10 -7 моль ионов ОН – .
Следовательно, электролитом-стабилизатором при образовании мицелл гидроксида железа (3) ни при каких условиях не может выступать вода (как источник ионов ОН – и Н +). Зато другие ионы - Fe 3+ , FeO + , Cl – могут участвовать в стабилизации коллоидных частиц. Исходя из этих рассуждений, построим две возможные формулы мицелл золя, не забывая при этом, что гидроксид железа является веществом аморфным, а потому активно адсорбирующим молекулы растворителя. Это означает, что обе возможные мицеллы будут иметь гидрофильную природу.
Случай 1) : потенциалопределяющие ионы – Fe 3+ ·pH 2 O; противоионы - 3Сl - ·(q+ℓ)H 2 O. При этих условиях формула гидрофильной мицеллы золя Fe(OH) 3 будет иметь вид: {[(m(Fe(OH) 3 ·rH 2 O·nFe 3+ ·pH 2 O) 3 n+ ·3(n-x)Cl – ·qH 2 O] 3 x+ + 3xCl – ·ℓH 2 O} 0 .
Случай 2) : потенциалопределяющие ионы – FeO + ·pH 2 O; противоионы - Сl - ·(q+ℓ)H 2 O. Мицелла гидрофильная, её формула
{[(m(Fe(OH) 3 ·rH 2 O·nFeО + ·pH 2 O) n+ ·(n-x)Cl – ·qH 2 O] x+ + xCl – ·ℓH 2 O} 0 .
В обоих случаях гранулы имеют положительный заряд и в электрическом поле перемещаются к катоду.
Ответ : возможно образование двух гидрофильных мицелл с гранулами положительного заряда
{[(m(Fe(OH) 3 ·rH 2 O·nFeО + ·pH 2 O) n+ ·(n-x)Cl – ·qH 2 O] x+ + xCl – ·ℓH 2 O} 0
и {[(m(Fe(OH) 3 ·rH 2 O·nFe 3+ ·pH 2 O) 3 n+ ·3(n-x)Cl – ·qH 2 O] 3 x+ + 3xCl – ·ℓH 2 O} 0 .
4 . Золь берлинской лазури можно получить при взаимодействии неэквивалентных количеств разбавленных растворов железа (3) хлорида и калия феррицианата K 4 . Напишите формулы мицелл гидрофобных золей, имея в виду, что комплексные ионы подвергаются гидратации с такой же силой, как и простые.
Решение . В основе образования коллоидных растворов лежит реакция обмена, приводящая к формированию нерастворимой фазы:
4FeCl 3 + 3K 4 = ↓Fe 4 3 + 12KCl.
Нерастворимые частицы гексацианоферрата (2) железа (3) образуют зародыш коллоида, причем гидрофобный, т.к. вещество имеет кристаллическое строение. В зависимости от того, какая из солей взята в избытке, потенциалопределяющими ионами могут выступить либо гидратированные анионы 4- ·рН 2 О, либо гидратированные катионы Fe 3+ ·pH 2 O. Соответственно, противоионами будут в разных случаях либо 4К + ·(q+ℓ)H 2 O, либо 4Cl - ·(q+ℓ)H 2 O.
На основании проведенного анализа составим формулы возможных мицелл:
а) С N K 4 > С N FeCl 3 , тогда
{[ (m(Fe 4 3 ·n 4- ·рН 2 О) 4 n- ·4(n-x)K + ·q(H 2 O)] 4 x- + 4xK + ·ℓH 2 O} 0 ;
б) С N K 4 < С N FeCl 3 , тогда
{[(m(Fe 4 3 ·nFe 3+ ·pH 2 O) 3 n+· 3(n-x)Cl - ·qH 2 O] 3 x+ + 3xCl - ·ℓH 2 O} 0 .
Хотя обе мицеллы являются гидрофобными, но заряды их гранул противоположны по знаку. Если смешать растворы в эквивалентных количествах, произойдет компенсация зарядов на этапе формирования гранул и мицеллы скоагулируют (произойдет их разрушение).
Ответ : формулы образующихся в двух различных случаях мицелл имеют вид:
а) {[(m(Fe 4 3 ·n 4- ·рН 2 О) 4 n- ·4(n-x)K + ·q(H 2 O)] 4 x- + 4xK + ·ℓH 2 O} 0 ;
б) {[(m(Fe 4 3 ·nFe 3+ ·pH 2 O) 3 n+· 3(n-x)Cl - ·qH 2 O] 3 x+ + 3xCl - ·ℓH 2 O} 0 .
5 . Рассчитайте объем 0,0025 М. раствора KI, который необходимо добавить к 0,035 л 0,003 н. раствора Pb(NO 3) 2 , чтобы получить гидрофобный золь иодида свинца и при электрофорезе его противоионы двигались к аноду. Постройте формулу мицеллы золя.
Решение . Как уже подчеркивалось не раз, в основе образования коллоидного раствора лежит реакция обмена, приводящая к формированию нерастворимой дисперсной фазы: 2KI + Pb(NO 3) 2 = ↓PbI 2 + 2 KNO 3 .
Если противоионы мицеллы при электрофорезе перемещаются к аноду, следовательно, они заряжены отрицательно, а потенциалопределяющими ионами являются положительные ионы. Согласно правилу Пескова-Фаянса, для дисперсной фазы PbI 2 таковыми могут быть только катионы свинца Pb 2+ . Отсюда ясно, что электролитом-стабилизатором выступает раствор нитрата свинца Pb(NO 3) 2 и противоионами становятся анионы NO 3 - .
При таких условиях электролит-стабилизатор должен быть в избытке, следовательно,
С N (Pb(NO 3) 2 ·V(Pb(NO 3) 2 > C N (KI)·V(KI).
Решим полученное неравенство относительно объема раствора иодида калия, помня, что С N (KI) = C μ (KI) = 0,0025 моль/л.
V(KI) < [С N (Pb(NO 3) 2 ·V(Pb(NO 3) 2 ]/C N (KI);
V(KI) < (0,003·0,035)/0,0025 < 0,042 (л).
Это означает, что для получения золя иодида свинца необходимо использовать меньше 42 мл раствора иодида калия с концентрацией 0,0025 моль/л.
Формула гидрофобной мицеллы золя иодида свинца имеет вид:
Ответ : для получения золя иодида свинца с положительной гранулой и отрицательными противоионами нужно использовать менее 42 мл раствора KI;
мицелла золя имеет гидрофобную природу, её формула
{[(m(PbI 2)·nPb 2+ ·pH 2 O) 2 n+ ·2(n-x)NO 3 - ·qH 2 O] 2 x+ + 2xNO 3 - ·ℓH 2 O} 0 .
Напишите формулу мицеллы золя сульфата бария, полученного при взаимодействии раствора хлорида бария с небольшим избытком раствора сульфата натрия?
Решение:
В основе получения золя лежит реакция:
BaCl 2 + Na 2 SО 4 изб. = 2 NaCl + Ba SО 4 ¯
Условием получения золя является избыток Na 2 SО 4 , который является стабилизатором золя.
В растворе будут присутствовать ионы натрия и сульфат-ионы, образующиеся при диссоциации сульфата натрия
Na 2 SO 4 = 2Na + + SO²⁻
На поверхности агрегатов будут адсорбироваться сульфат-ионы.
Образуетсяя ядро коллоидной частицы:
[(BaSO 4) m ∙nSO²⁻
Несущее отрицательный заряд ядро притягивает из раствора ионы противоположного знака, называемые противоионами. В нашем случае в роли противоионов выступают катионы натрия.
формула мицеллы полученного золя:
{[(BaSO 4) m ·nSO²⁻]2(n-x)Na + } 2x- 2xNa +
К какому электроду будут перемещаться частицы золя полученного при взаимодействии нитрата серебра с избытком хлорида натрия?
Решение . При смешивании растворов AgNO3 и NaCl изб. протекает реакция
AgNO3+ NaСl (изб.) = AgСl + NaNO3.
Ядро коллоидной частицы золя хлорида серебра состоит из агрегата молекул (mAgСl) и зарядообразующих ионов Cl ⁻, которые находятся в растворе в избытке и обеспечивают коллоидным частицам отрицательный заряд. Противоионами являются гидратированные ионы натрия.
Формула мицеллы хлорида серебра имеет вид:
[m (AgCl) n Cl – (n– x )Na + ] x – x Na +
Коллоидная частица имеет отрицательный заряд, значит будет перемещаться к положительно заряженному электроду - катоду.
Напишите формулы мицелл коллоидных растворов для следующих веществ:
а) кремниевый кислоты: агрегат m [Н2SiO3], ионный стабилизатор K2SiO3 ® 2K+ + SiO32–
б) гидрозоля золота: агрегат m [Аu], ионный стабилизатор NaAuO2 ® Na + + AuO2–
в) двуокиси олова: агрегат m , ионный стабилизатор K2SnO3 ® 2K+ + SnO32–
Решение:
а) Образование золя кремневой кислоты происходит по реакции
K 2 SiO 3 изб.+ 2HCl = H 2 SiO 3 + 2KCl.
K 2 SiO 3 2K⁺+ SiO₃²⁻
На электронейтральном агрегате частиц (mH 2 SiO 3) адсорбируются ионы элемента, входящего в состав ядра. Таковыми являются ионы HSiO 3 ‾ , которые образуются в результате гидролиза соли K 2 SiO 3:
K 2 SiO 3 + H 2 O KHSiO 3 + KOH или в ионной форме
SiO 3 2− + H 2 O HSiO 3 ‾ + OH ‾ .
Ионы HSiO 3 ‾ , адсорбируясь на поверхности частиц золя кремниевой кислоты, сообщают им отрицательный заряд. Противоионами являются гидратированные ионы водорода H + . Формула мицеллы золя кремневой кислоты:
{[(m H 2 SiO 3) ·n HSiO 3 ‾ ·(n-x )H + ∙y H 2 O] x − + x H + ∙z H 2 O}.
б) Образование гидрозоля золота происходит при действии восстановителя на соль золотой кислоты в слабощелочной среде:
2NaAuО 2 + 3НСНО + Na 2 CO 3 = 2Аu + ЗНСООNa + NaНСО 3 + Н 2 О.
На агрегате частиц (mAu) адсорбируются ионы элемента, входящего в состав ядра. Таковыми являются ионы AuO 2 ‾ ,
Формула мицеллы золя:
{m·nAuO²⁻·(n-x) Na⁺} x ⁻ ·xNa⁺
в) Образование золя двуокиси олова происходит следующим образом:
K2SnO3 2K⁺ + SnO3²⁻
На электронейтральном агрегате частиц (mSnO 2) адсорбируются ионы элемента, входящего в состав ядра. Таковыми являются ионы SnO 3 2‾:
K 2 SnO 3 SnO 3 2⁻ + 2K⁺
Ионы SnO 3 2‾ , адсорбируясь на поверхности частиц золя, сообщают им отрицательный заряд. Противоионами являются ионы K + . Формула мицеллы золя двуокиси олова:
{[(m SnO 2) n SnO 3 2‾ ·(2n-x )K + ] 2 − + x K + }.
Мицелла – это структурная коллоидная единица. Необходимыми условиями образования мицеллы являются:
а) образование в результате реакции труднорастворимого вещества, m молекул которого образуют агрегат коллоидной частицы.
Например: ;
б) наличие стабилизатора – электролита, предоставляющего ионы, адсорбируемые поверхностью труднорастворимого соединения. Согласно правилу Панетта–Фаянса , лучше всего адсорбируется тот ион, который входит в состав кристаллической решетки адсорбента . Абсорбируемые ионы, достраивающие кристаллическую решетку труднорастроримого соединения, называют потенциал определяющими ионами коллоидной частицы , поскольку заряд частицы совпадает по знаку с зарядом этих ионов. Адсорбция потенциалопределяющих ионов происходит самопроизвольно, сопровождаясь уменьшением свободной энергии поверхности ядра (∆G s).
Стабилизатором, как правило, является исходное вещество, взятое в избытке. Если в рассматриваемой реакции в избытке берется соль , то она будет стабилизатором. И тогда адсорбируемым ионом будет ион .


Рис. 4. Схема строения коллоидной
мицеллы: 1 – адсорбционный слой; 2 – слой потивоионов; 3 – диффузный слой
При избытке соли , стабилизатор предоставляет иодид-ионы, избирательно адсорбируемые поверхностью :

Агрегат с потенциал определяющими ионами образуют ядро мицеллы .
Другие ионы стабилизатора (противоионы ) образуют около твердой поверхности два слоя:адсорбционный (неподвижный), прочно связанный с ядром, и диффузионный (подвижный), расположенный на определенном расстоянии от ядра в дисперсионной среде. Ядро совместно с адсорбционным слоем противоионов называется коллоидной частицей (гранулой) .
Строение мицеллы удобно представлять в виде формулы. Для золя формула мицеллы пишется так, если стабилизатором будет
если стабилизатором будет AgNO 3:

Если стабилизатор , то формула мицеллы запишется так:

Количества потенциалопределяющих ионов и противоионов должны соответствовать их стехиометрии в молекуле стабилизатора. Поскольку поверхностная энергия на ядре коллоидной частицы больше поверхностной энергии на слое потенциалопределяющих ионов, то противоионов адсорбируется на x меньше. Ядро вместе с адсорбционным слоем (слоем потенциалопределяющих ионов и частью противоионов) составляет гранулу. Коллоидная частица (гранула), окруженная противоионами электролита, называется мицеллой. Мицелла – нейтральная частица, а коллоидная частица, как правило имеет заряд, знак и величина которого определяются электрокинетическим потенциалом x, возникающим на границе между адсорбционным и диффузным слоем.
При использовании реакции обмена состав мицелл зависит от того, что к чему приливать!